摘要:1 mol.生成的CO2和O2通入另一份Na2O2与NaHCO3的混合物中.只发生反应:2CO2+2Na2O2=2Na2CO3+O2.反应后气体的物质的量变为 =0.09mol.导致此变化有两种可能: (1)Na2O2过量.最后剩余气体全部为O2.则: 2CO2 - O2 △V 2 1 x mol 得x=0.02 mol.故原0.1 mol混合气体中含n(O2)=0.08 mol.所以每一份混合物中含n(NaHCO3)=n(CO2)=0.02 mol.含n(Na2O2)=0.08 mol×2=0.16 mol.得n(Na2O2):n(NaHCO3)=0.16 mol:0.02 mol=8:1.则此时 c(HCl)= =3.4mol/L. (2)若Na2O2不足.则产生的气体为CO2与O2的混合物.则: 2Na2O2-2CO2-O2 △V 2 1 y mol y=0.02 mol. 此时每一份混合物中含n(Na2O2)=0.02mol.生成m(O2)= ×0.02mol=0.01 mol.故产生CO2为0.1 mol-0.01 mol=0.09 mol.故含n(NaHCO3)=0.09 mol.所以n(Na2O2):n(NaHCO3)=0.02:0.09=2:9.此时c(HCl)= =1.3mol/L. 答:略.
网址:http://m.1010jiajiao.com/timu3_id_237996[举报]
 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.(1)许多化学反应的反应热可以直接测量,测量仪器叫做
量热计
量热计
.(2)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
(填序号);表示中和热的是△H6
△H6
(填“△H1、△H2、或△H3”等).A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热a kJ,下列热化学方程式正确是
C
C
.A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
2590.4kJ
2590.4kJ
.(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
433.75
433.75
.SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(1)上述四种气体中直接排入空气时会引起酸雨的有 (填化学式).
(2)NO2与CO能发生可逆反应生成CO2和NO,该反应中每生成1 g CO2 (g)时,放出5.13kJ热量.
①上述反应中氧化剂与还原剂的质量之比为 .
②写出上述反应的热化学方程式: .
③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是 (填字母).
a.体系压强保持不变b.混合气体的颜色保持不变c.NO的物质的量保持不变d.每生成1 mol SO3的同时消耗1mol NO2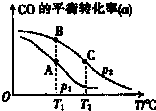
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g)在一容积可变的密闭容器中充有10mol CO与20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.
①上述合成甲醇的反应为 (填“放热”或“吸热”)反应.
②A、B、C三点中CH3OH(g)的体积分数最大的是 (填“A”“B”或“C”).
查看习题详情和答案>>
(1)上述四种气体中直接排入空气时会引起酸雨的有
(2)NO2与CO能发生可逆反应生成CO2和NO,该反应中每生成1 g CO2 (g)时,放出5.13kJ热量.
①上述反应中氧化剂与还原剂的质量之比为
②写出上述反应的热化学方程式:
③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是
a.体系压强保持不变b.混合气体的颜色保持不变c.NO的物质的量保持不变d.每生成1 mol SO3的同时消耗1mol NO2

(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g)在一容积可变的密闭容器中充有10mol CO与20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.
①上述合成甲醇的反应为
②A、B、C三点中CH3OH(g)的体积分数最大的是
近来,制备和利用氢气这一清洁能源已有多项成果.
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:
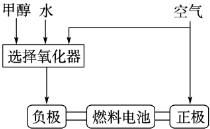
①燃料电池的正极反应式为 ;
②甲醇与流程图中任一反应物反应制取氢气的化学方程式 .
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
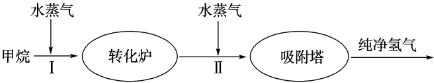
①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
表1
表2
③若400℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2(单位为kJ),第1步反应的热化学方程式为:
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 .
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是 .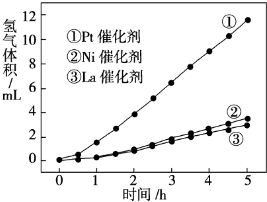
查看习题详情和答案>>
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:

①燃料电池的正极反应式为
②甲醇与流程图中任一反应物反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
表1
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是
