题目内容
 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.(1)许多化学反应的反应热可以直接测量,测量仪器叫做
量热计
量热计
.(2)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
(填序号);表示中和热的是△H6
△H6
(填“△H1、△H2、或△H3”等).A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热a kJ,下列热化学方程式正确是
C
C
.A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
2590.4kJ
2590.4kJ
.(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
433.75
433.75
.分析:(1)测量反应热的常用仪器为量热计;
(2)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量;
(3)在25℃、101kPa下,15g乙烷完全燃烧生成CO2和液态水,放热a kJ,30g乙烷燃烧生成CO2和液态水时放热a kJ×2=2akJ,1mol乙烷质量为30克,所以完全燃烧1mol乙烷生成二氧化碳和液态水放热2aKJ,根据燃烧热的概念分析即可解答;
(4)CO2恰好与KOH溶液完全反应生成正盐为K2CO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒由n(CO2)=n(K2CO3),进而计算丁烷的物质的量,据此计算;
(5)根据反应热等于反应物的总键能与生成物的总键能之差,结合反应热计算键能.
(2)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量;
(3)在25℃、101kPa下,15g乙烷完全燃烧生成CO2和液态水,放热a kJ,30g乙烷燃烧生成CO2和液态水时放热a kJ×2=2akJ,1mol乙烷质量为30克,所以完全燃烧1mol乙烷生成二氧化碳和液态水放热2aKJ,根据燃烧热的概念分析即可解答;
(4)CO2恰好与KOH溶液完全反应生成正盐为K2CO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒由n(CO2)=n(K2CO3),进而计算丁烷的物质的量,据此计算;
(5)根据反应热等于反应物的总键能与生成物的总键能之差,结合反应热计算键能.
解答:解:(1)用于测定物质的热容及各种反应热的仪器,叫量热计,也称量热仪、量热器,
故答案为:量热计;
(2)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热;
B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热;
C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热;
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热;
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热;
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7反应生成的水为2mol,反应热△H7不能表示中和热,
故答案为:△H4、△H5;△H6;
(3)A.C2H6(g)+
O2(g)═2CO2(g)+3H2O(l);△H1=+2a kJ/mol在热化学反应方程式中△H>0,表示吸热,而C2H6燃烧反应是放热反应,故A错误;
B.C2H6(g)+
O2(g)═2CO2(g)+3H2O(g);△H2=-2a kJ/mol,完全燃烧1mol乙烷生成二氧化碳和液态水放热2akJ,该方程式表示的是气态水,故B错误;
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故C正确;
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故D错误;
故选:C.
(4)KOH的物质的量为0.1L×5mol/L=0.5mol,根据钾离子守恒,故n(K2CO3)=0.5mol×
=0.25mol,
根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
根据碳元素守恒可知,丁烷的物质的量n(C4H10)=
×0.25mol,放出热量161.9kJ,
所以1mol丁烷完全燃烧放出的热量为161.9kJ×16=2590.4kJ,
故答案为:2590.4kJ;
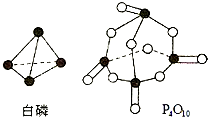
(5)白磷燃烧的热化学方程式为P4(s)+5O2(g)═P4O10(s)△H=-2378.0kJ/mol,
则6×197kJ/mol+5×499kJ/mol-12×360kJ/mol-4X=-2378kJ/mol,
X=433.75kJ/mol,
故答案为:433.75.
故答案为:量热计;
(2)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热;
B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热;
C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热;
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热;
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热;
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7反应生成的水为2mol,反应热△H7不能表示中和热,
故答案为:△H4、△H5;△H6;
(3)A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故C正确;
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故D错误;
故选:C.
(4)KOH的物质的量为0.1L×5mol/L=0.5mol,根据钾离子守恒,故n(K2CO3)=0.5mol×
| 1 |
| 2 |
根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
根据碳元素守恒可知,丁烷的物质的量n(C4H10)=
| 1 |
| 4 |
所以1mol丁烷完全燃烧放出的热量为161.9kJ×16=2590.4kJ,
故答案为:2590.4kJ;
(5)白磷燃烧的热化学方程式为P4(s)+5O2(g)═P4O10(s)△H=-2378.0kJ/mol,
则6×197kJ/mol+5×499kJ/mol-12×360kJ/mol-4X=-2378kJ/mol,
X=433.75kJ/mol,
故答案为:433.75.
点评:本题主要考查燃烧热与中和热的概念、反应热的有关计算、热化学方程式的意义等,注意中和热与燃烧热概念的把握,难点是白磷、P4O10结构及键能计算反应热,题目难度中等.

练习册系列答案
相关题目
从下列实验事实所引起的相应结论不正确的是( )
|