题目内容
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(1)上述四种气体中直接排入空气时会引起酸雨的有 (填化学式).
(2)NO2与CO能发生可逆反应生成CO2和NO,该反应中每生成1 g CO2 (g)时,放出5.13kJ热量.
①上述反应中氧化剂与还原剂的质量之比为 .
②写出上述反应的热化学方程式: .
③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是 (填字母).
a.体系压强保持不变b.混合气体的颜色保持不变c.NO的物质的量保持不变d.每生成1 mol SO3的同时消耗1mol NO2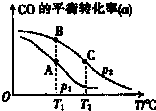
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g)在一容积可变的密闭容器中充有10mol CO与20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.
①上述合成甲醇的反应为 (填“放热”或“吸热”)反应.
②A、B、C三点中CH3OH(g)的体积分数最大的是 (填“A”“B”或“C”).
(1)上述四种气体中直接排入空气时会引起酸雨的有
(2)NO2与CO能发生可逆反应生成CO2和NO,该反应中每生成1 g CO2 (g)时,放出5.13kJ热量.
①上述反应中氧化剂与还原剂的质量之比为
②写出上述反应的热化学方程式:
③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是
a.体系压强保持不变b.混合气体的颜色保持不变c.NO的物质的量保持不变d.每生成1 mol SO3的同时消耗1mol NO2

(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g)在一容积可变的密闭容器中充有10mol CO与20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.
①上述合成甲醇的反应为
②A、B、C三点中CH3OH(g)的体积分数最大的是
分析:(1)酸雨与二氧化硫及氮的氧化物有关;
(2)NO2与CO能发生可逆反应生成CO2和NO,发生NO2(g)+CO(g)?CO2(g)+NO(g),
①N元素的化合价降低,C元素的化合价升高,则氧化剂为NO2,还原剂为CO;
②生成1 g CO2 (g)时,放出5.13kJ热量,生成1 mol CO2 (g)时,放出5.13kJ×44=225.72kJ的热量,以此书写热化学方程式;
③利用平衡的特征“等、定”及由此衍生的一些物理量来判断;
(3)①由图可知,相同压强时,温度越大,CO的转化率越小,即升高温度,平衡逆向移动;
②A、B相同温度,B点CO的转化率大,B、C相同压强,C点CO的转化率小,CO的转化率越大,CH3OH(g)的体积分数越大.
(2)NO2与CO能发生可逆反应生成CO2和NO,发生NO2(g)+CO(g)?CO2(g)+NO(g),
①N元素的化合价降低,C元素的化合价升高,则氧化剂为NO2,还原剂为CO;
②生成1 g CO2 (g)时,放出5.13kJ热量,生成1 mol CO2 (g)时,放出5.13kJ×44=225.72kJ的热量,以此书写热化学方程式;
③利用平衡的特征“等、定”及由此衍生的一些物理量来判断;
(3)①由图可知,相同压强时,温度越大,CO的转化率越小,即升高温度,平衡逆向移动;
②A、B相同温度,B点CO的转化率大,B、C相同压强,C点CO的转化率小,CO的转化率越大,CH3OH(g)的体积分数越大.
解答:解:(1)酸雨与二氧化硫及氮的氧化物有关,则引起酸雨的有SO2、NO、NO2,故答案为:SO2、NO、NO2;
(2)NO2与CO能发生可逆反应生成CO2和NO,发生NO2(g)+CO(g)?CO2(g)+NO(g),
①N元素的化合价降低,C元素的化合价升高,则氧化剂为NO2,还原剂为CO,氧化剂与还原剂的质量之比为46:28=23:14,故答案为:23:14;
②生成1 g CO2 (g)时,放出5.13kJ热量,生成1 mol CO2 (g)时,放出5.13kJ×44=225.72kJ的热量,热化学方程式为NO2(g)+CO(g)?CO2(g)+NO(g)△H=-225.72kJ/mol,故答案为:NO2(g)+CO(g)?CO2(g)+NO(g)△H=-225.72kJ/mol;
③a.由反应可知,反应前后气体的物质的量总和不变,体系压强始终保持不变,不能判定平衡状态,故a错误;
b.混合气体的颜色保持不变,即二氧化氮的浓度不变,达到平衡状态,故b正确;
c.NO的物质的量保持不变,达到平衡状态,故C正确;
d.每生成1 mol SO3的同时消耗1mol NO2,只能判断正反应速率,不能确定正逆反应速率的关系,不能判定平衡状态,故d错误;
故答案为:ad;
(3)①由图可知,相同压强时,温度越大,CO的转化率越小,即升高温度,平衡逆向移动,所以正反应为放热反应,故答案为:放热;
②A、B相同温度,B点CO的转化率大,B、C相同压强,C点CO的转化率小,CO的转化率越大,CH3OH(g)的体积分数越大,所以B点对应的CH3OH(g)的体积分数最大,故答案为:B.
(2)NO2与CO能发生可逆反应生成CO2和NO,发生NO2(g)+CO(g)?CO2(g)+NO(g),
①N元素的化合价降低,C元素的化合价升高,则氧化剂为NO2,还原剂为CO,氧化剂与还原剂的质量之比为46:28=23:14,故答案为:23:14;
②生成1 g CO2 (g)时,放出5.13kJ热量,生成1 mol CO2 (g)时,放出5.13kJ×44=225.72kJ的热量,热化学方程式为NO2(g)+CO(g)?CO2(g)+NO(g)△H=-225.72kJ/mol,故答案为:NO2(g)+CO(g)?CO2(g)+NO(g)△H=-225.72kJ/mol;
③a.由反应可知,反应前后气体的物质的量总和不变,体系压强始终保持不变,不能判定平衡状态,故a错误;
b.混合气体的颜色保持不变,即二氧化氮的浓度不变,达到平衡状态,故b正确;
c.NO的物质的量保持不变,达到平衡状态,故C正确;
d.每生成1 mol SO3的同时消耗1mol NO2,只能判断正反应速率,不能确定正逆反应速率的关系,不能判定平衡状态,故d错误;
故答案为:ad;
(3)①由图可知,相同压强时,温度越大,CO的转化率越小,即升高温度,平衡逆向移动,所以正反应为放热反应,故答案为:放热;
②A、B相同温度,B点CO的转化率大,B、C相同压强,C点CO的转化率小,CO的转化率越大,CH3OH(g)的体积分数越大,所以B点对应的CH3OH(g)的体积分数最大,故答案为:B.
点评:本题考查较综合,涉及环境污染、氧化还原反应、反应热的计算及热化学方程式、化学平衡及状态判定、化学平衡图象及平衡移动影响因素等,侧重分析能力、计算能力及知识迁移应用能力的考查,综合性较强,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.