摘要:元素在周期表中的位置.反映了元素的原子结构和元素的性质.下列说法正确的是( ) A.同一元素不可能既表现金属性.又表现非金属性 B.第三周期元素的最高正化合价等于它所处的主族序数 C.短周期元素形成离子后.最外层电子都达到8电子稳定结构 D.同一主族的元素的原子.最外层电子数相同.化学性质完全相同 [解析]选B.处于元素周期表金属与非金属分界线附近的元素.既表现金属性.又表现非金属性.A错误,主族元素的最高正化合价等于它所处的主族序数.也等于其最外层电子数.B正确,H+ .Li+ 的最外层电子分别是0.2.C项错误,同一主族的元素的原子最外层电子数虽相同.但是核电荷数.原子半径不同.化学性质不完全相同.D错误.
网址:http://m.1010jiajiao.com/timu3_id_235002[举报]
阅读下表中的部分短周期主族元素的相关信息
请回答下列问题:
(1)描述Z元素在周期表中的位置:
(2)T、X、Y元素简单离子半径由大到小的顺序为:(填离子符号)
(3)已知1mol 化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是
②根据上图提供的信息,试推断E氟
查看习题详情和答案>>
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)描述Z元素在周期表中的位置:
第三周期第ⅦA族
第三周期第ⅦA族
(2)T、X、Y元素简单离子半径由大到小的顺序为:(填离子符号)
O2->Na+>Al3+
O2->Na+>Al3+
(3)已知1mol 化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式
SO32-+ClO-=SO42-+Cl-
SO32-+ClO-=SO42-+Cl-
.(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是
增大
增大
.②根据上图提供的信息,试推断E氟
>
>
E氧(填“>”“<”或“=”).(2013?通州区二模)四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
(2)BC2分子的电子式
 ;
;
(3)A元素的单质与物质甲发生反应的离子方程式
(4)丙的钠盐溶液呈
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
②
③
查看习题详情和答案>>
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
第2周期ⅣA族
第2周期ⅣA族
;(2)BC2分子的电子式


(3)A元素的单质与物质甲发生反应的离子方程式
Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
;(4)丙的钠盐溶液呈
碱
碱
性,用化学用语表示其原因Cl-+H2O?HClO+OH-
Cl-+H2O?HClO+OH-
;(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
;②
2H2O2=2H2O+O2↑
2H2O2=2H2O+O2↑
;过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
;③
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
.(2010?崇文区一模)四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
 .
.
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式.
①A元素的单质与物质甲发生的反应
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.①
查看习题详情和答案>>
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
第2周期IVA族
第2周期IVA族
,请写出BC2分子的电子式

(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式.
①A元素的单质与物质甲发生的反应
Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
.②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应
Al2O3+2OH-═2AlO-2+H2O
Al2O3+2OH-═2AlO-2+H2O
.(3)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.①
发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+
发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+
②过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
③溶液中存在平衡Fe3++2H2O?Fe(OH)3+3H+,反应①使c(H+)降低且反应②放热,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀
溶液中存在平衡Fe3++2H2O?Fe(OH)3+3H+,反应①使c(H+)降低且反应②放热,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀
.(2013?红桥区一模)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质B的组成元素在周期表中的位置是
(2)戊的化学式为
(3)NaClO的电子式为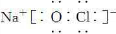
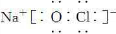 .
.
(4)甲与水反应的化学方程式为
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
查看习题详情和答案>>

请回答:
(1)单质B的组成元素在周期表中的位置是
第2周期第ⅤA族
第2周期第ⅤA族
.(2)戊的化学式为
Al(OH)3
Al(OH)3
.戊与强碱反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)NaClO的电子式为
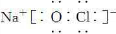
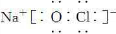
(4)甲与水反应的化学方程式为
AlN+3H2O=Al(OH)3↓+NH3↑
AlN+3H2O=Al(OH)3↓+NH3↑
.(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
2NH3+NaClO═N2H4+NaCl+H2O
2NH3+NaClO═N2H4+NaCl+H2O
.(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
.(2010?石景山区一模)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)E元素在周期表中的位置为
(2)由A、B、W三种元素组成的18电子微粒的电子式为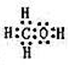
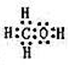 .
.
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
查看习题详情和答案>>
(1)E元素在周期表中的位置为
第三周期,IIIA族
第三周期,IIIA族
.(2)由A、B、W三种元素组成的18电子微粒的电子式为
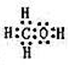
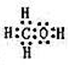
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式
H2O2 H++HO2-
H++HO2-
 H++HO2-
H++HO2-H2O2 H++HO2-
H++HO2-
.常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 H++HO2-
H++HO2-BaO2+H2SO4=BaSO4↓+H2O2
BaO2+H2SO4=BaSO4↓+H2O2
.(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
Cu+2H++H2O2=Cu2++2H2O
Cu+2H++H2O2=Cu2++2H2O
.(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是
56L
56L
(标准状况下).(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
.