题目内容
(2013?通州区二模)四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
(2)BC2分子的电子式
 ;
;
(3)A元素的单质与物质甲发生反应的离子方程式
(4)丙的钠盐溶液呈
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
②
③
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
第2周期ⅣA族
第2周期ⅣA族
;(2)BC2分子的电子式


(3)A元素的单质与物质甲发生反应的离子方程式
Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
;(4)丙的钠盐溶液呈
碱
碱
性,用化学用语表示其原因Cl-+H2O?HClO+OH-
Cl-+H2O?HClO+OH-
;(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
;②
2H2O2=2H2O+O2↑
2H2O2=2H2O+O2↑
;过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
;③
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
.分析:根据信息及甲的比例模型知,甲是水,由氢氧两种元素组成;根据乙的信息及比例模型知,乙是甲烷,由碳、氢两种元素组成;丙是具有强氧化性的弱酸,且能消毒,则丙是次氯酸,由氢、氯、氧三种元素组成,原子半径大小:A>B>C>D
,所以A是Cl元素,B是O元素,C是C元素,D是H元素.
,所以A是Cl元素,B是O元素,C是C元素,D是H元素.
解答:解:根据信息及甲的比例模型知,甲是水,由氢氧两种元素组成;根据乙的信息及比例模型知,乙是甲烷,由碳、氢两种元素组成;丙是具有强氧化性的弱酸,且能消毒,则丙是次氯酸,由氢、氯、氧三种元素组成,原子半径大小:A>B>C>D,所以A是Cl元素,B是C元素,C是O元素,D是H元素.
(1)B在周期表中处于第二周期第IVA族,故答案为:第2周期ⅣA族;
(2)BC2分子是CO2,它的电子式为: ,故答案为:
,故答案为: ;
;
(3)A元素的单质是氯气,氯气和水反应生成盐酸和次氯酸,反应离子方程式为:Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(4)丙的钠盐溶液是次氯酸钠溶液,次氯酸钠是强碱弱酸盐,水解导致其钠盐溶液呈碱性,水解方程式为:Cl-+H2O?HClO+OH-,故答案为:碱性,Cl-+H2O?HClO+OH-;
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构,则丁是双氧水,向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,说明亚铁离子被双氧水氧化生成铁离子;
②有少量气泡出现(经验证是氧气),说明双氧水分解生成氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈;
③反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁),向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色,氢氧化铁和硫酸反应生成硫酸铁,
故答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色);
②过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈;
③反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁).
(1)B在周期表中处于第二周期第IVA族,故答案为:第2周期ⅣA族;
(2)BC2分子是CO2,它的电子式为:
 ,故答案为:
,故答案为: ;
;(3)A元素的单质是氯气,氯气和水反应生成盐酸和次氯酸,反应离子方程式为:Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(4)丙的钠盐溶液是次氯酸钠溶液,次氯酸钠是强碱弱酸盐,水解导致其钠盐溶液呈碱性,水解方程式为:Cl-+H2O?HClO+OH-,故答案为:碱性,Cl-+H2O?HClO+OH-;
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构,则丁是双氧水,向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,说明亚铁离子被双氧水氧化生成铁离子;
②有少量气泡出现(经验证是氧气),说明双氧水分解生成氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈;
③反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁),向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色,氢氧化铁和硫酸反应生成硫酸铁,
故答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色);
②过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈;
③反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁).
点评:本题考查较综合,正确推断元素、化合物是解本题关键,难点是分析(5)②中速率变大的原因.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
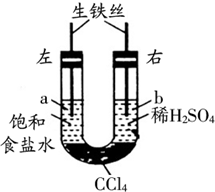 (2013?通州区二模)如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )
(2013?通州区二模)如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )