网址:http://m.1010jiajiao.com/timu3_id_232783[举报]
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
(1)按A、B、C顺序,三种元素的金属性逐渐
(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
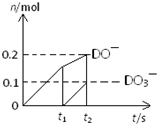
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为
溶氧分析仪能连续、自动测量水中微量的溶解氧含量,可用于工业锅炉用水,实验室制备除氧水等方面。溶氧分析仪的核心部件是氧传感器,传感器中银做阳极,金做阴极,二电极之间连接一稳定的直流电源,以氯化钾溶液为电解质溶液,电解质溶液与取样水之间有一层氧气可以透过的薄膜,测量金电极上产生的还原电流的大小得出氧气的含量。
⑴ 试写出溶氧分析仪的有关电极反应式
阴极_______________________________,阳极____________________________________
⑵ 请从你写的电极反应式推测影响氧传感器的性能的因素可能有哪些?
在高温下高炉中氧含量的测定可用氧化锆(ZrO2)氧传感器来测定,在氧化锆中加入MgO,Y2O3等立方晶系的氧化物后,在600℃以上高温时成为氧的快离子导体。其导电性能主要源于掺杂晶体中的氧离子空位。下图为氧化锆固体电解质的导电原理。
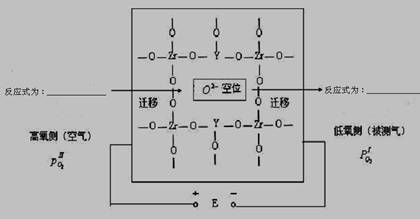
⑶ 写出高氧侧和低氧侧的电极反应式
高氧侧______________________________,低氧侧________________________________
⑷ 若某掺杂电极Y2O3的ZrO2晶体中氧离子空位数为3.01×1020个,则理论上掺杂的Y2O3质量为多少克?
查看习题详情和答案>>⑴ 试写出溶氧分析仪的有关电极反应式
阴极_______________________________,阳极____________________________________
⑵ 请从你写的电极反应式推测影响氧传感器的性能的因素可能有哪些?
在高温下高炉中氧含量的测定可用氧化锆(ZrO2)氧传感器来测定,在氧化锆中加入MgO,Y2O3等立方晶系的氧化物后,在600℃以上高温时成为氧的快离子导体。其导电性能主要源于掺杂晶体中的氧离子空位。下图为氧化锆固体电解质的导电原理。
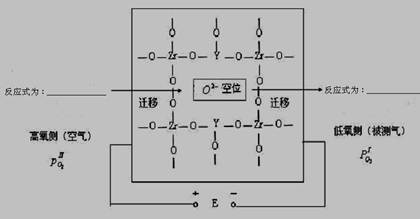
⑶ 写出高氧侧和低氧侧的电极反应式
高氧侧______________________________,低氧侧________________________________
⑷ 若某掺杂电极Y2O3的ZrO2晶体中氧离子空位数为3.01×1020个,则理论上掺杂的Y2O3质量为多少克?

回答下列问题:
(1)操作I后得到的母液中镁离子浓度为1.8×10-3 mol?L-1,要使镁离子产生沉淀,溶液的pH最低应为
(2)利用MgCl2?6H2O制备无水氯化镁,需在干燥的
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3?H2O,还发生另一主要化学反应的离子方程式为
(4)某科研小组研究反应I在温度为378K~398K时的反应时间、反应物配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表(表中不要留空格):
| 实验 编号 |
T/K | 反应 时间/h |
反应物的物质的量配比 n[CO(NH2)2]:n[MgCl2?6H2O] |
实验目的 |
| ① | 378 | 3 | 3:1 | (Ⅰ)实验①和③探究 反应物的物质的量配比对产率的影响 反应物的物质的量配比对产率的影响 删除此空 删除此空 ;(Ⅱ)实验②和④探究 温度对产率的影响 温度对产率的影响 ;(Ⅲ)实验②和 ③ ③ 探究反应时间对产率的影响. |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

小明等同学为了探究酸、碱、盐溶液的导电性,设计了如下实验:
1.在5只250mL烧杯分别加入浓度均为0.1mol·L-1的盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各150mL。
2.在5种溶液中分别放入相同规格的石墨电极,按下图连接好。

3.接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论: 。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论: 。
思考:
1.酸、碱、盐溶液导电与金属导电的原理是否相同,为什么?
2.同学们为了探究不同电解质之间电离能力的差异,设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可) 。
3.小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?
。
4.为了进一步探究氯化氢等化合物是强电解质,小红同学在老师的帮助下测定了0.1mol·L-1的盐酸中的氢离子浓度,通过对结果的分析,即可得出结论。说明氯化氢是强电解质的理由是:测得溶液中的氢离子浓度 0.1mol·L-1(选填>、<、=)。
5.同学们在实验的基础上,进一步查阅资料得知:一般来说, 是强电解质, 是弱电解质。根据以上结论推测:如果将上述实验中的醋酸和氨水混匀,然后分别盛放在原来的烧杯中。接通电源,可以观察到的现象是:
A.与混合前无任何区别。
B.5只灯泡都亮起来,亮度完全相同。
C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来,另外两只不亮。
D.5个灯泡都亮起来,盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,另外两只略暗,但明显比混合前明亮。
查看习题详情和答案>>