题目内容
溶氧分析仪能连续、自动测量水中微量的溶解氧含量,可用于工业锅炉用水,实验室制备除氧水等方面。溶氧分析仪的核心部件是氧传感器,传感器中银做阳极,金做阴极,二电极之间连接一稳定的直流电源,以氯化钾溶液为电解质溶液,电解质溶液与取样水之间有一层氧气可以透过的薄膜,测量金电极上产生的还原电流的大小得出氧气的含量。
⑴ 试写出溶氧分析仪的有关电极反应式
阴极_______________________________,阳极____________________________________
⑵ 请从你写的电极反应式推测影响氧传感器的性能的因素可能有哪些?
在高温下高炉中氧含量的测定可用氧化锆(ZrO2)氧传感器来测定,在氧化锆中加入MgO,Y2O3等立方晶系的氧化物后,在600℃以上高温时成为氧的快离子导体。其导电性能主要源于掺杂晶体中的氧离子空位。下图为氧化锆固体电解质的导电原理。
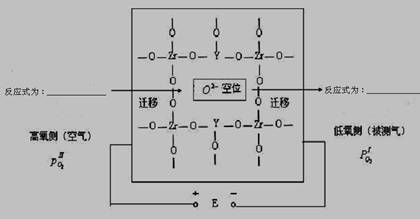
⑶ 写出高氧侧和低氧侧的电极反应式
高氧侧______________________________,低氧侧________________________________
⑷ 若某掺杂电极Y2O3的ZrO2晶体中氧离子空位数为3.01×1020个,则理论上掺杂的Y2O3质量为多少克?
⑴ 阴极反应 O2 + 2H2O + 4e == 4OH-
阳极反应 Ag – e- + Cl- == AgCl (2分 ,各1分)
⑵ pH值,H2S的浓度,重金属离子 (写出二个即可) (2分)
⑶ O2+ 4e - === 2O2- , 2O2- — 4e- === O2 (2分 ,各1分)
⑷ 每掺杂1molY2O3得到的氧离子空位为1mol, 计算得Y2O3质量为:
(3.01X1020/NA) ??M Y2O3 =1.13??10-1g (三位有效数字)(2分)
解析:
⑴此问中,一个关键问题是要判断该电化学装置的类型。虽然题中各种描述,该装置是电解池,但是从测量原理等方面来看,这却是一个原电池装置。该装置利用原电池产生的电流对稳定直流电的抵消作用,来测量电流强度,进而确定O2的浓度。因此,在正极,O2+ 2H2O + 4e == 4OH- ,由于O2的浓度不一样,影响了该电对的电极电势。负极Ag失电子,并与Cl-形成沉淀。
⑵影响氧传感器的因素就是影响⑴中两个电极电极电势大小的因素。正极的电势与溶液pH有关,负极由于Ag(Ⅰ)的存在形式会影响到该电极的电极电势,因此影响Ag(Ⅰ)存在形式的因素都会对氧传感器的性能产生影响。
⑶根据题意,该固体电解质中载荷离子为O2-,因此与恒定电流正极相连一侧,即高氧侧,失去电子,产生还原电流,因此电极反应式为:O2+ 4e - === 2O2- 。另一侧O2-得电子生成O2。
⑷氧离子空位的物质的量为3.01×1020/6.02×1023=5.00×10-4(mol),每一个Y3+置换一个Zr4+,正电荷减小1,因此根据电荷守恒原理n(Y)=2n(Y2O3) =5.00×10-4×2 mol,得n(Y2O3)=5.00×10-4 mol,从而求得其摩尔质量。

(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
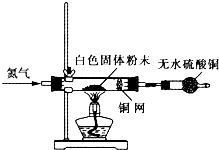
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是