摘要:4.在[Cu(NH3)4]2+溶液中滴加1mol·dm-3中滴加1mol·dm-3 H2SO4时.可观察到逐渐出现天蓝色沉淀.继续滴加H2SO4.沉淀逐渐溶解形成浅蓝色溶液.试用方程式解释观察到的现象.
网址:http://m.1010jiajiao.com/timu3_id_232766[举报]
海水中主要离子的含量如下:
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示) .
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 .
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是 .
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是 .
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是 .
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量 ,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为 %[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以lg/cm3计].
查看习题详情和答案>>
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量
(1)在盛有鸡蛋白溶液的试管里,缓慢地加入饱和的硫酸氢溶液,观察到的现象是
(2)蛋白质、淀粉、脂肪是三种重要的营养物质,其中
(3)下列有机实验操作或叙述正确的是
(A)用银氨溶液检验某病人是否患糖尿病
(B)乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
(C)蔗糖水解时应用浓硫酸作催化剂
(D)在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
(E)在植物油中滴入溴水,溴水褪色
(F)用盐析法分离油脂皂化反应的产物
(G)在酒精中加新制生石灰后蒸馏制无水酒精
(H)制酚醛树脂时,应将温度计插入水浴中.
查看习题详情和答案>>
变浑浊
变浑浊
.这种现象叫盐析
盐析
.再向试管里加入足量的蒸馏水,观察到的现象是变澄清
变澄清
,这说明盐析
盐析
是一个可逆反应利用这个性质,可以采用多次盐析
盐析
的方法分离、提纯蛋白质.(2)蛋白质、淀粉、脂肪是三种重要的营养物质,其中
脂肪
脂肪
不是高分子化合物,这三种物质水解的最终产物分别是蛋白质→氨基酸
氨基酸
;淀粉→葡萄糖
葡萄糖
;脂肪→高级脂肪酸和甘油
高级脂肪酸和甘油
;在蛋白质水解的最终产物分子中,含有官能团:-COOH和-NH2
-COOH和-NH2
.(3)下列有机实验操作或叙述正确的是
BDEFG
BDEFG
(填写代号).(A)用银氨溶液检验某病人是否患糖尿病
(B)乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
(C)蔗糖水解时应用浓硫酸作催化剂
(D)在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
(E)在植物油中滴入溴水,溴水褪色
(F)用盐析法分离油脂皂化反应的产物
(G)在酒精中加新制生石灰后蒸馏制无水酒精
(H)制酚醛树脂时,应将温度计插入水浴中.
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5?H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb4+具有很强的氧化性.水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
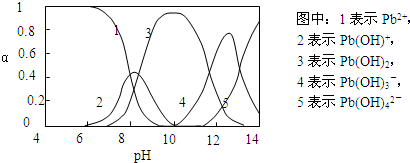
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为
查看习题详情和答案>>
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1
>
>
K2(填“>”、“=”或“<”).②判断该反应达到化学平衡状态的依据是
AC
AC
(填序号).A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
N2H62++H2O [N2H5?H2O]++H+
[N2H5?H2O]++H+
 [N2H5?H2O]++H+
[N2H5?H2O]++H+N2H62++H2O [N2H5?H2O]++H+
[N2H5?H2O]++H+
. [N2H5?H2O]++H+
[N2H5?H2O]++H+②盐酸肼水溶液中离子浓度的排列顺序正确的是
A
A
(填序号).A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5?H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb4+具有很强的氧化性.水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:

(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)
<
<
1/2(填“>”、“=”、“<”).(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为
PbCl2
PbCl2
.(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为
10
10
时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清.pH=13时,混合体系中发生的主要反应的离子方程式为:Pb(OH)3-+OH-=Pb(OH)42-
Pb(OH)3-+OH-=Pb(OH)42-
.