题目内容
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
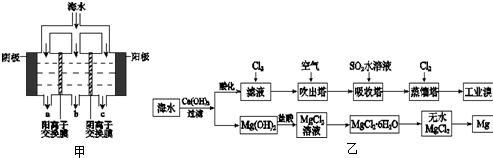
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量
(2)阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子,钙离子,氢氧根离子和碳酸氢根离子反应生成生成白色沉淀碳酸钙;
(3)根据氯化钠的溶解度受温度影响不大,所以蒸发的目的是析出晶体,同时蒸发至有较多晶体析出时停止加热;判断溶液已饱和的现象是溶液表面形成晶膜;
(2)①根据Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)计算C(OH-),然后判断酸碱性;
②加入盐酸除去HCO3-,防止钙离子干扰;根据5×10-4mol/L的氢氧化镁溶解在水中,所以它就是这个误差值.
故答案为:HCO3-+H2O?H2CO3+OH-;
(2)在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子,钙离子,氢氧根离子和碳酸氢根离子反应生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2;Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)①氯化钠的溶解度受温度影响不大,所以蒸发的目的是析出晶体,同时蒸发至有较多晶体析出时停止加热,故选:bd;
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,当溶液表面形成晶膜说明溶液已饱和;
故答案为:溶液表面形成晶膜;
(4)①饱和Mg(OH)2溶液中Mg(OH)2溶液的浓度为5×10-4mol/L,由Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)可得,C(OH-)=5×10-4mol/L×2=1×10-3mol/L,c(H+)=
| 1×10-14 |
| 1×10-3 |
故答案为:溶液变红;
②海水中含有HCO3-,钙离子,氢氧根离子和碳酸氢根离子反应生成白色沉淀碳酸钙,影响测定结果,所以加入盐酸除去HCO3-,防止钙离子干扰;溶解的氢氧化镁:5×10-4mol/L×24g/mol=12mg/L,与表中1272mg/L的“真值”比,相对误差约为-
| 12 |
| 1272 |
故答案为:盐酸;-0.94%;

(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。