网址:http://m.1010jiajiao.com/timu3_id_232600[举报]
(1)0.5 mol Na2CO3的质量为________g,其中含有________个Na+.
(2)质量都是50 g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是________.
(3)在________mL 0.2 mol/L NaOH溶液中含4 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O________g.
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=______.
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=______kJ/mol.
(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是______.
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是______.
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为______mol.
查看习题详情和答案>>
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+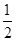 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+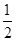 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则: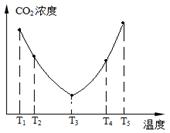
①ΔH3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
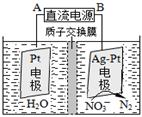
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,电源正极为: (选填填“A”或“B”),阴极反应式为: 。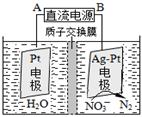
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+
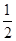 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1C(s)+
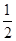 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1写出焦炭与水蒸气反应的热化学方程式: 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则:
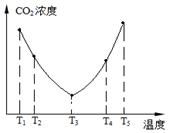
①ΔH3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,电源正极为: (选填填“A”或“B”),阴极反应式为: 。