题目内容
(2010?丰台区二模)汽车尾气中含有CO和氮氧化物.治理尾气的方法是在排气管上安一个催化转化器,其中发生如下反应:2NO+2CO?N2+2CO2.
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=
.
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
-746
-746
kJ/mol.(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
③④
③④
.①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是
②③
②③
.①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为
0.05
0.05
mol.分析:(1)根据化学平衡常数K=
来书写;
(2)根据盖斯定律来计算反应的焓变;
(3)根据K的影响因素、影响化学反应速率的因素、化学平衡移动原理以及平衡状态的判断知识来回答;
(4)①酸性氧化物是能和碱反应生成盐和水的氧化物;
②CO2的大量排放会导致温室效应;
③氮气与氧气,在高温条件下会生成氮的氧化物;
(5)根据二氧化碳和氢氧化钠反应的化学方程式进行计算.
| 所有产物系数次幂的乘积 |
| 所有反应物系数次幂的乘积 |
(2)根据盖斯定律来计算反应的焓变;
(3)根据K的影响因素、影响化学反应速率的因素、化学平衡移动原理以及平衡状态的判断知识来回答;
(4)①酸性氧化物是能和碱反应生成盐和水的氧化物;
②CO2的大量排放会导致温室效应;
③氮气与氧气,在高温条件下会生成氮的氧化物;
(5)根据二氧化碳和氢氧化钠反应的化学方程式进行计算.
解答:解:(1)反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的化学平衡常数K=
,故答案为:
;
(2)a、CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
b、N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
根据盖斯定律,反应2NO(g)+2CO(g)?N2(g)+2CO2(g)和a、b两个反应的关系是,该反应=2a-b,
所以反应的焓变=2×(-283kJ/mol)-180kJ/mol=-746KJ/mol,故答案为:-746;
(3)①可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g)是一个放热反应,所以升高温度,平衡常数减小,故①错误;
②升高温度,正、逆反应速率均升高,故②错误;
③单位时间内消耗CO和CO2的物质的量相等时,正逆反应速率相等,反应达到平衡,故③正确;
④反应达到平衡后,其他条件不变,缩小容器容积,压强增大,平衡向气体体积减小的方向即生成N2 和CO2的方向移动,故④正确;
故选③④;
(4)①酸性氧化物是能和碱反应生成盐和水的氧化物,NO、CO、CO2;均不能和酸反应,故①错误;
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行,节能减排,故②正确;
③氮气与氧气,在高温条件下会生成氮的氧化物,故③正确;
故选②;
(5)根据二氧化碳和氢氧化钠反应:a、CO2+2NaOH=Na2CO3+H2O,b、Na2CO3+H2O+CO2=2NaHCO3,2.24L即0.1molCO2气体被0.15molNaOH溶液全部吸收.则
CO2 +2NaOH=Na2CO3+H2O,Na2CO3 +H2O+CO2 =2NaHCO3
0.075 0.15 0.075 0.025 (0.1-0.075)mol 0.05
所以溶液最后的组成是生成碳酸钠和碳酸氢钠均为0.05mol,故答案为:0.05.
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
(2)a、CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
b、N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
根据盖斯定律,反应2NO(g)+2CO(g)?N2(g)+2CO2(g)和a、b两个反应的关系是,该反应=2a-b,
所以反应的焓变=2×(-283kJ/mol)-180kJ/mol=-746KJ/mol,故答案为:-746;
(3)①可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g)是一个放热反应,所以升高温度,平衡常数减小,故①错误;
②升高温度,正、逆反应速率均升高,故②错误;
③单位时间内消耗CO和CO2的物质的量相等时,正逆反应速率相等,反应达到平衡,故③正确;
④反应达到平衡后,其他条件不变,缩小容器容积,压强增大,平衡向气体体积减小的方向即生成N2 和CO2的方向移动,故④正确;
故选③④;
(4)①酸性氧化物是能和碱反应生成盐和水的氧化物,NO、CO、CO2;均不能和酸反应,故①错误;
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行,节能减排,故②正确;
③氮气与氧气,在高温条件下会生成氮的氧化物,故③正确;
故选②;
(5)根据二氧化碳和氢氧化钠反应:a、CO2+2NaOH=Na2CO3+H2O,b、Na2CO3+H2O+CO2=2NaHCO3,2.24L即0.1molCO2气体被0.15molNaOH溶液全部吸收.则
CO2 +2NaOH=Na2CO3+H2O,Na2CO3 +H2O+CO2 =2NaHCO3
0.075 0.15 0.075 0.025 (0.1-0.075)mol 0.05
所以溶液最后的组成是生成碳酸钠和碳酸氢钠均为0.05mol,故答案为:0.05.
点评:本题考查的知识点有:平衡常数表达式的书写、盖斯定律的应用、影响平衡常数、化学反应速率的因素、化学平衡移动原理以及平衡状态的判断等,属于综合知识的考查,难度较大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
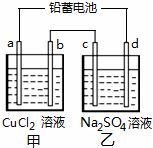 (2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
(2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: