��Ŀ����
��Ⱦ�뻷�������Ѿ���Ϊ�����ҹ������ŵ�һ�����⣬��Ⱦ��Ϊ������Ⱦ��ˮ��Ⱦ��������Ⱦ�ȡ�
��1��Ϊ�˼��ٿ�����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2(g)��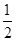 O2(g)=H2O(g) ��H1����241.8 kJ��mol��1
O2(g)=H2O(g) ��H1����241.8 kJ��mol��1
C(s)��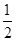 O2(g)=CO(g) ��H2����110.5 kJ��mol��1
O2(g)=CO(g) ��H2����110.5 kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�÷�Ӧ��ƽ�ⳣ������ʽΪK�� ��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ����� ��ѡ����ţ���
a��Ca(OH)2 b��CaCl2 c��Na2CO3 d��NaHSO3
��2��Ϊ�˼��ٿ����е�CO2��Ŀǰ��̼�����ڽ������������ŷ��о�����Ҫ�����ã���̼������(NH4)2CO3����ӦΪ��(NH4)2CO3(aq)��H2O(l)��CO2(g)��2NH4HCO3(aq) ��H3Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壨�õ�����Ϊϡ�ͼ�������tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ����ϵ��ͼ����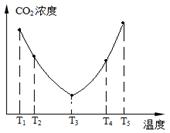
�٦�H3 0(�����������������)��
����T4��T5����¶����䣬������CO2����Ũ�ȱ仯���Ƶ�ԭ���ǣ� ��
��3�������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
�ٴ����������У���H2��NO3-��ԭΪN2��һ��ʱ�����Һ�ļ���������ǿ����Ӧ���ӷ���ʽΪ�� ��
�ڵ绯ѧ����NO3-��ԭ����ͼ����Դ����Ϊ�� ��ѡ���A����B������������ӦʽΪ�� ��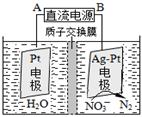
��1���� C(s)��H2O(g) �� CO(g) ��H2(g) ��H����131.3kJ��mol��1 k��c CO)��c( H2)/c(H2O)
�� a c����1�֣�
��2���� <
�� T4��T5 ��Ӧ��ƽ�⣬����ӦΪ���ȷ�Ӧ�������¶ȵ����ߣ�ƽ�������ƶ���CO2������Ч�ʽ��ͣ���NH4HCO3���ַֽ⣬��˼��������֣���
��3����2 NO3����5H2 N2��2OH����4H2O
N2��2OH����4H2O
��A 2 NO3����12 H+��10e��= N2����6H2O
���������������1���������������Ȼ�ѧ����ʽ��ʽ����ʽ����C(s)��H2O(g) �� CO(g) ��H2(g) ��H����131.3kJ��mol��1�����Լ�Ca(OH)2��Na2CO3���������Ӧ��������Ϊ�����ռ�����2���ٸ�ͼ����ͬʱ��ʱ�ⶨ�Ķ�����̼��Ũ�ȣ��¶�Խ�߷�Ӧ����Խ�죬�ȴ�ƽ�⣬����ͼ���T3Ϊ�磬������ƽ�����ߣ��ݴ˷����¶ȸ߶�����̼������ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����H3< 0����T4��T5 ��Ӧ��ƽ�⣬����ӦΪ���ȷ�Ӧ�������¶ȵ����ߣ�ƽ�������ƶ���CO2������Ч�ʽ��ͣ���3���÷�Ӧ�������ϼ����ߣ�������Һ������ǿ����������OH�����ɴ���д����ʽ��������B�����ĵ缫NO3���õ���������N2��Ϊ��������AΪ������BΪ������
���㣺���黯ѧԭ���ۺ����ݡ�

 һ����������ϵ�д�
һ����������ϵ�д���ѧ��һֱ�����ڡ��˹��̵����ķ����о���
(1)�ϳɰ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3(g)��H="-92.4" kJ/mol���÷�Ӧ�������仯��ͼ��ʾ��
2NH3(g)��H="-92.4" kJ/mol���÷�Ӧ�������仯��ͼ��ʾ��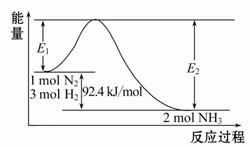
���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�� (���������С�����䡱)��
�ڽ�0.3 mol N2��0.5 mol H2�������������ܱ������У���һ�������´ﵽƽ�⣬�������������ѹǿ��Ϊԭ����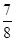 ����ʱH2��ת����Ϊ ������߸�������H2��ת���ʣ����д�ʩ���е��� (��ѡ����ĸ)��
����ʱH2��ת����Ϊ ������߸�������H2��ת���ʣ����д�ʩ���е��� (��ѡ����ĸ)��
| A���������а�ԭ�����ٳ���ԭ���� |
| B�����������ٳ���һ����H2 |
| C���ı䷴Ӧ�Ĵ��� |
| D��Һ�������������� |
2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)��H="+1" 530 kJ/mol
��֪��H2O(l)
 H2O(g) ��H="+44.0" kJ/mol
H2O(g) ��H="+44.0" kJ/mol��2N2(g)+6H2O(g)
 4NH3(g)+3O2(g) ��H= kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �����������������䣬����ѹǿ��Kֵ (���������С�����䡱)��
4NH3(g)+3O2(g) ��H= kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �����������������䣬����ѹǿ��Kֵ (���������С�����䡱)�� ͭ���ʼ��仯�����ڹ�ҵ�����Ϳ���������Ҫ���á�
��1����֪��2Cu2O(s) + O2(g) = 4CuO(s)��H����292kJ��mol��1
2C(s)+O2(g)=2CO(g) ��H����221kJ��mol��1
��д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ�� ��
��2�������Ȼ�ͭ����(CuCl2��2H2O�����Ȼ���������)��ȡ������CuCl2��2H2O���Ƚ����Ƴ�ˮ��Һ������ͼ��������ᴿ: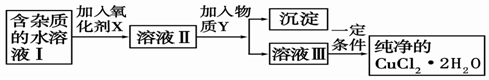
��֪Cu2+��Fe3+��Fe2+���������↑ʼ�����ͳ�����ȫʱ��pH���±�
| �������� | Fe3+ | Fe2+ | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |
��ش���������:
������������NaClO��H2O2��KMnO4��X�����ֺã�Ϊʲô������������������������������������������������������
�÷�Ӧ�����ӷ���ʽΪ ��
����ҺII�г�Cu2+�⣬���������������������ӣ���μ�������� ��
������Y����Ϊ���е�
a��CuO b��Cu(OH)2 c��CuCO3 d��Cu2(OH)2CO3 e��CaO f��NaOH
��������Һ���м���̼��ƣ�������������������������������������������
�����Ź㷺����;�������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ������
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ������Ӧ�����ɰ�����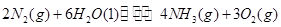
�÷�Ӧ�ڹ̶�������ܱ������н��У��й�˵����ȷ����_____________���������ĸ����
A����Ӧ����ƽ��״̬ʱ��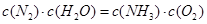 |
B����Ӧ�ﵽƽ���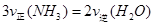 |
| C����ϵ����ѹǿ���䣬˵����Ӧ�Ѵ�ƽ�� |
| D�����������ܶȱ��ֲ��䣬˵����Ӧ�Ѵ�ƽ�� |
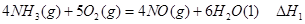 ��
��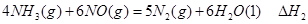 ��
��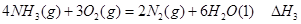 ��
����д������������Ӧ��
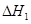 ��
��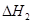 ��
��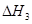 ����֮���ϵ�ı���ʽ��
����֮���ϵ�ı���ʽ��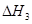 ��_________��
��_________����3����ҵ���������Ҫ��Ӧ�ǣ�
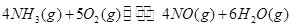
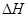 ��
��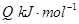
�������¶ȣ���Ӧ��Kֵ��С����Q______���>������<��������0��
������Ӧ��ʼ�����ʵ�����ͬ�����й�ϵͼ�������________������ţ���


�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ�Ũ�����±���
| ʱ��/Ũ�� |  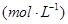 | 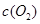 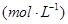 | 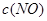 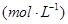 | 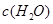 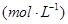 |
| ��ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | a | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
��Ӧ�ڵ�2 min����4 minʱ��O2��ƽ����Ӧ����Ϊ________��
��Ӧ�ڵ�2 minʱ�ı����������ı������������______________________________��
�������£���Ӧ��ƽ�ⳣ��K��________��
������һЩ���ʵ��۷е����ݣ���ѹ����
| | �� | �� | Na2CO3 | ���ʯ | ʯī |
| �۵㣨�棩 | 63��65 | 97��8 | 851 | 3550 | 3850 |
| �е㣨�棩 | 774 | 882��9 | 1850���ֽ����CO2�� | ---- | 4250 |
�����ƺ�CO2�ڳ�ѹ��890�淢�����·�Ӧ��4 Na��g��+ 3CO2��g��
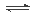 2 Na2CO3��l��+ C(s,���ʯ) ��H=��1080��9kJ/mol
2 Na2CO3��l��+ C(s,���ʯ) ��H=��1080��9kJ/mol��1������Ӧ��10L�ܱ���������ѹ�½��У��¶���890�����ߵ�1860�棬����Ӧʱ��Ϊ10min, �����Ƶ����ʵ���������0��2mol����10min��CO2��ƽ����Ӧ����Ϊ ��
��2����ѹ�������ڽ��ʯ���Ʊ��������� ��
��3����CO2��g��+ 4Na��g��=2Na2O��s��+ C��s�����ʯ�� ��H=��357��5kJ/mol����Na2O������C�����ʯ����Ӧ�õ�Na��g����Һ̬Na2CO3��l�����Ȼ�ѧ����ʽ ��
��4����ͼ����K��Mʱ��ʯī�缫��ӦʽΪ ��
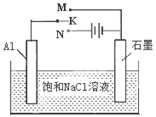
��5��������ԭ���ԭ�����ʵ�飬��֤Cu2����Ag+�����Ե�ǿ����
�ڷ����ڻ���ʵ��װ��ͼ��Ҫ�����ձ�������(��ͬһ�ձ��У�
�缫����Һ����ͬ�Ľ���Ԫ��)����������·��������
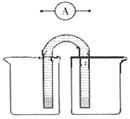
 2Fe(s)��3CO(g)����H����492.7 kJ��mol��1
2Fe(s)��3CO(g)����H����492.7 kJ��mol��1 CO(g)��3H2(g)����H����206.2 kJ��mol��1
CO(g)��3H2(g)����H����206.2 kJ��mol��1 H++CN������Ħ�HΪ kJ��mol��1
H++CN������Ħ�HΪ kJ��mol��1 O2(g)��CO(g)
O2(g)��CO(g)  ="-111.0" KJ��mol-1
="-111.0" KJ��mol-1 CH3OCH3��H2O
CH3OCH3��H2O CH3OCH3(g)��CO2(g) ��H����247kJ/mol
CH3OCH3(g)��CO2(g) ��H����247kJ/mol

