摘要:短周期元素中.族序数等于同期数的两倍的两元素形成的化合物的化学式是: A.CS2 B.CO2 C.SO2 D.SiO2
网址:http://m.1010jiajiao.com/timu3_id_210758[举报]
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价.
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式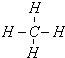
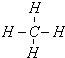
(3)B的氢化物和E的氢化物反应所得生成物的电子式为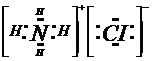
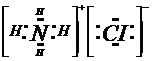 .
.
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
查看习题详情和答案>>
(1)写出E元素在周期表中的位置
第三周期第VIIA族
第三周期第VIIA族
(2)写出A元素气态氢化物的结构式
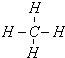
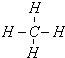
(3)B的氢化物和E的氢化物反应所得生成物的电子式为
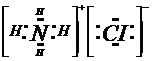
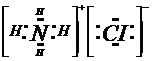
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.(1)E在元素周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
(2)由A、C、F三种元素按原子个数比、1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式
3HClO+2NH3=3HCl+N2+3H2O
3HClO+2NH3=3HCl+N2+3H2O
.(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
| c(H+)甲 | c(H+)乙 |
10-4
10-4
;乙溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)用如图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
,溶液中出现的现象是产生气泡,有白色沉淀生成
产生气泡,有白色沉淀生成
.短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为34,且原子的最外层电子数之和为10;A、C的原子最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
查看习题详情和答案>>
短周期元素A、B、C、D、E的原子序数依次增大,A的一种同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A、A-离子半径小于B+离子半径 | B、B单质在C单质中燃烧生成原子个数比为1:1的化合物 | C、D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | D、D与E组成的化合物中,各原子最外层均达到8电子结构 |