网址:http://m.1010jiajiao.com/timu3_id_210220[举报]
氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向_____方向移动。
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______ Ksp(AgBr)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式_________________。
查看习题详情和答案>>我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键??? b.氢键??? c.金属键??? d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中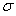 键与
键与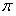 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
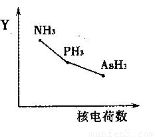
a.稳定性??????? b.沸点?????? c.R—H键能?????? d.分子间作用力
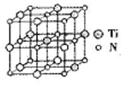
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
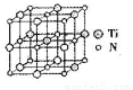
查看习题详情和答案>>
常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外只有三个能级,且各能级电子数相等 |
|
Y |
Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
|
Z |
Z的基态价电子结构为nsn-1 |
|
W |
W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
(1)Y位于元素周期表第 周期 族,其基态原子未成对电子有 个。
(2)X的电负性比W的 (填“大”或“小”);Y的最简单气态氢化物比X的最简单气态氢化物易液化,其主要原因是 。
(3)Z与同周期左右相邻的两种元素的原子相比较,三者第一电离能由大到小的顺序为 (用元素符号表示)。Y和Z形成的化合物为 晶体,该物质遇水强烈水解的化学方程式为 。
(4)在一定温度下,向一个容积不变的密闭容器中充入1molY2和3mol氢气,发生反应:Y2(g)+3H2(g) 2YH3(g) ΔH=-akJ/mol。在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K= 。若起始向此容器中充入2molYH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为 (用一个式子表示)。
查看习题详情和答案>>
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。
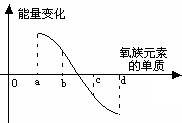 查看习题详情和答案>>
查看习题详情和答案>>
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中
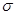 键与
键与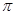 个数的比值为___________________。
个数的比值为___________________。(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
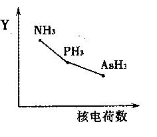
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。