网址:http://m.1010jiajiao.com/timu3_id_208524[举报]
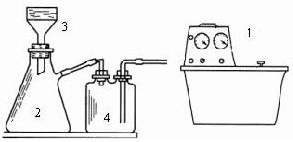
①加热NaNO2(一种致癌物质,有毒)与NH4Cl的混合物浓溶液制取N2;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热条件下用NH3还原CuO得纯净的N2和活性铜粉.
如图所示,给出了按上述途径制取N2可供选择的几种实验装置:

请回答下列问题:
(1)按途径①制取N2时,应选用上述装置中的
(2)若只需较纯净的N2,有同学建议把②和③两条途径协同使用,这样做的好处是
(3)按途径③制取N2时,若气流从左到右的顺序所需的上述装置是:A→C→B→D.在A装置中所需要的试剂是
①甲同学:为通过实验现象验证C处有水产生,必须在C装置前后都连接E装置,其中填充的固体药品按前后顺序分别为
②乙同学:实验过程中,发现黑色固体完全变红,质疑此时红色固体可能含Cu2O.通过查阅资料知:Cu2O+2H+=Cu2++Cu+H2O.依据信息,请设计实验证明C处的红色固体中是否含有Cu2O:
③丙同学:实验时充分加热,至C装置硬质玻管质量不再减轻为止.实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况),硬质玻管质量减轻了bg.则氨分子中氮、氢的原子个数比为(用含a、b的字母的代数式表示)
| 16a |
| 22.4b |
| 16a |
| 22.4b |
(4)目前工业上用氮气和氢气直接合成氨,氨经一系列反应可制得硝酸.在以上各步反应中,按要求完成化学反应方程式:
①氮元素只发生还原反应
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
②氮元素既发生氧化反应又发生还原反应:
 煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.
煤的干馏是煤气化的重要方法,是煤综合利用最“古老”的方法,也是最简单的方法,所谓煤的干馏是在隔绝空气和高温的条件下,煤可以发生分解,生成固态的焦炭、液态的煤焦油、气态的焦炉气.下面是某实验小组设计的煤干馏实验,装置如图所示.取约2~3g的煤粒,在研钵中研磨至粉末状态;用药匙将煤粉放入玻璃管中,在具支试管中加入2mL水,然后按照如图所示安装好装置;点燃酒精灯,对玻璃管均匀受热后再集中受热,注意观察具支试管中气泡产生的速度;待具支试管中气泡产生的速度均匀后,用明火靠近具支试管的支管口处,可以观察到产生的气体能够燃烧.根据上述实验设计回答下列问题:
(1)实验结束后,应该先把玻璃管从溶液中取出,然后再熄灭酒精灯,这样操作的目的是
(2)焦炉气是一种混合性的可燃性气体,点燃焦炉气前必须进行
(3)取下具支试管,可以发现其中的液体分为两层,上层是
A、B、C、D、E均为钠盐,D、E具有相同的元素组成,都是由四种元素组成的化合物。向B溶液中滴加硝酸酸化的硝酸银溶液,立即产生白色沉淀,该沉淀见光变暗至灰至黑。A、B或B、C溶液混合均无明显现象,若将A、B、E和B、C、E分别按1:5:6和1:1:2的物质的量之比混合,溶液都能产生有刺激性气味黄绿色气体甲。D、E溶液混合能产生具有漂白性的刺激性气体乙。甲与乙混合气体通入水中会产生两种酸。B与E固体混合不反应,加热则能产生有刺激性气味的气体丙。若将气体丙通入A或C溶液中均能产生气体甲。甲气体通入D溶液,颜色会消失。若将A、D、E按2:1:1物质的量之比混合,能产生黄色气体丁。
请回答下列有关问题:
⑴.完成下列反应的离子方程式并配平之。
①.A + B + E → : ▲
②.D + E → : ▲
③.甲+乙+ H2O → : ▲
④.A + D + E → : ▲
⑵.丁气体消毒漂白性比甲强,是更理想的漂白试剂。相同条件下,相同体积的丁气体处理水的能力是甲的 ▲ 倍;相同质量的丁气体处理水的能力是甲的 ▲ 倍。
⑶.历史上曾把某元素的最高价的含氧酸称为某酸,如N、P、S等。A盐中对应的酸并不是该元素的最高价的含氧酸(当时误认为是最高价)。电解技术进入化学研究领域后,通过惰性材料电解A的水溶液,产生新的含氧酸盐(M=122.5 g·mol-1),我们可以把与其对应的酸称为高某酸。取出100 mL A盐溶液进行电解(惰性电极,通直流电),数小时后,收集到的阴、阳两极气体分别为6.72L和2.24L(已经折算成标准状况下的气体体积) 。
①.阴、阳两极所发生的电极反应离子方程式为 ▲ 、 ▲ 。
②.原A盐溶液的物质的量浓度为 ▲ 。(假设溶液体积变化忽略不计)
查看习题详情和答案>>
实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.
试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是
(3)步骤⑤中用冰水和乙醇洗涤的目的是,
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是
(6)本次实验的NaFeEDTA?3H2O的实际产率为:
C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下

①把0.4g(0.0lmol)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为_________________。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是___________________________;加显色利后分别发生反应的离子方程式为_______________________;_________________________。
(3)步骤⑤中用冰水和乙醇洗涤的目的是,_________________,_________________。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:__________________________________。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是_________________(写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为:_________________。