题目内容
B.铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇.1%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下:
实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
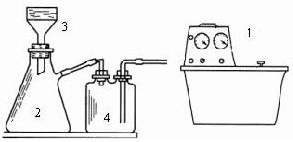
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.
试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是
(3)步骤⑤中用冰水和乙醇洗涤的目的是,
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是
(6)本次实验的NaFeEDTA?3H2O的实际产率为:
分析:乙二胺四乙酸铁钠(C10H12FeN2NaO8?3H2O)的制备:乙二胺四乙酸或乙二胺四乙酸钠盐与氯化铁、氢氧化钠混合,微热制取,实质是乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁,微热进行反应;
(1)该实验实质为乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁微热反应,碱过量会使产物中有氢氧化铁生成,提高纯度;
(2)纸上层析,利用混合物中各组分在两种不同溶剂中的分配系数不同而使物质分离的方法,丙酮对Fe3+的溶解度要大于Cu2+,含有Cu2+和Fe3+的溶液涂在滤纸一端,丙酮作展开剂,在滤纸的毛细作用下,Cu2+和Fe3+沿滤纸纤维向上移动的速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的;
(3)⑤冷却、采用减压过滤,先用冰水洗涤再用乙醇洗涤,洗涤除去晶体表面附着的Na2H2EDTA、氯化物等杂质,乙二胺四乙酸铁钠盐的溶解度受温度影响,它在冰水中的溶解度较小,用冰水洗涤,降低洗涤过程中NaFeEDTA?3H2O的损耗,用乙醇洗涤,乙醇具有挥发性,可以使乙二胺四乙酸铁钠盐快速干燥;
(4)物质的结晶注意事项;
(5)配合物中Fe3+的检验,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,溶液中含有Fe3+,检验Fe3+用SCN,故加入的铵盐应为NH4SCN,现象为溶液变为血红色;
(6)乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,由Na2H2EDTA?2H2O和FeCl3?6H2O发生反应得到,由原子守恒得C10H12FeN2NaO8?3H2O~Na2H2EDTA?2H2O~FeCl3?6H2O,由2.5g(0.009mol)FeCl3?6H2O和3.8g(0.01mol)Na2H2EDTA?2H2O反应,Na2H2EDTA?2H2O过量,故n(C10H12FeN2NaO8?3H2O)=n(FeCl3?6H2O)=0.009mol,理论上制得C10H12FeN2NaO8?3H2O的质量为m=nM=0.009mol×421g/mol=3.789g,实际制得成品2.8g,
NaFeEDTA?3H2O的实际产率=
×100%=
×100%=73.9%.
(1)该实验实质为乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁微热反应,碱过量会使产物中有氢氧化铁生成,提高纯度;
(2)纸上层析,利用混合物中各组分在两种不同溶剂中的分配系数不同而使物质分离的方法,丙酮对Fe3+的溶解度要大于Cu2+,含有Cu2+和Fe3+的溶液涂在滤纸一端,丙酮作展开剂,在滤纸的毛细作用下,Cu2+和Fe3+沿滤纸纤维向上移动的速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的;
(3)⑤冷却、采用减压过滤,先用冰水洗涤再用乙醇洗涤,洗涤除去晶体表面附着的Na2H2EDTA、氯化物等杂质,乙二胺四乙酸铁钠盐的溶解度受温度影响,它在冰水中的溶解度较小,用冰水洗涤,降低洗涤过程中NaFeEDTA?3H2O的损耗,用乙醇洗涤,乙醇具有挥发性,可以使乙二胺四乙酸铁钠盐快速干燥;
(4)物质的结晶注意事项;
(5)配合物中Fe3+的检验,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,溶液中含有Fe3+,检验Fe3+用SCN,故加入的铵盐应为NH4SCN,现象为溶液变为血红色;
(6)乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,由Na2H2EDTA?2H2O和FeCl3?6H2O发生反应得到,由原子守恒得C10H12FeN2NaO8?3H2O~Na2H2EDTA?2H2O~FeCl3?6H2O,由2.5g(0.009mol)FeCl3?6H2O和3.8g(0.01mol)Na2H2EDTA?2H2O反应,Na2H2EDTA?2H2O过量,故n(C10H12FeN2NaO8?3H2O)=n(FeCl3?6H2O)=0.009mol,理论上制得C10H12FeN2NaO8?3H2O的质量为m=nM=0.009mol×421g/mol=3.789g,实际制得成品2.8g,
NaFeEDTA?3H2O的实际产率=
| 成品质量 |
| 理论质量 |
| 2.8g |
| 3.789g |
解答:解:乙二胺四乙酸铁钠(C10H12FeN2NaO8?3H2O)的制备:乙二胺四乙酸或乙二胺四乙酸钠盐与氯化铁、氢氧化钠混合,微热制取,实质是乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁,微热进行反应;
(1)该实验实质为乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁微热反应,碱过量会使产物中有氢氧化铁生成,提高纯度;
故答案为:碱过量会使产物中有氢氧化铁生成,影响纯度;
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是纸上层析,利用混合物中各组分在两种不同溶剂中的分配系数不同而使物质分离的方法,丙酮对Fe3+的溶解度要大于Cu2+,含有Cu2+和Fe3+的溶液涂在滤纸一端,丙酮作展开剂,在滤纸的毛细作用下,Cu2+和Fe3+沿滤纸纤维向上移动的速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的;
故答案为:纸上层析;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Cu2++4NH3?H2O=Cu(NH3)42++4H2O;
(3)⑤冷却、采用减压过滤,先用冰水洗涤再用乙醇洗涤,洗涤除去晶体表面附着的Na2H2EDTA、氯化物等杂质,乙二胺四乙酸铁钠盐的溶解度受温度影响,它在冰水中的溶解度较小,用冰水洗涤,降低洗涤过程中NaFeEDTA?3H2O的损耗,用乙醇洗涤,乙醇具有挥发性,可以使乙二胺四乙酸铁钠盐快速干燥;
故答案为:用冰水洗涤可降低洗涤过程中NaFeEDTA?3H2O的损耗;用酒精洗涤可使其快速干燥;
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,证明结晶过程出现问题,可能的原因是:步骤④中溶剂蒸发速度快,步骤⑤冷却速率快;
故答案为:步骤④中溶剂蒸发速度快,步骤⑤冷却速率快;
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,溶液中含有Fe3+,检验Fe3+用SCN,故加入的铵盐应为NH4SCN,现象为溶液变为血红色;
故答案为:NH4SCN;
(6)乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,由Na2H2EDTA?2H2O和FeCl3?6H2O发生反应得到,由原子守恒得C10H12FeN2NaO8?3H2O~Na2H2EDTA?2H2O~FeCl3?6H2O,由2.5g(0.009mol)FeCl3?6H2O和3.8g(0.01mol)Na2H2EDTA?2H2O反应,Na2H2EDTA?2H2O过量,故n(C10H12FeN2NaO8?3H2O)=n(FeCl3?6H2O)=0.009mol,理论上制得C10H12FeN2NaO8?3H2O的质量为m=nM=0.009mol×421g/mol=3.789g,实际制得成品2.8g,
NaFeEDTA?3H2O的实际产率=
×100%=
×100%=73.9%,
故答案为:73.9%.
(1)该实验实质为乙二胺四乙酸或乙二胺四乙酸钠盐与氢氧化铁微热反应,碱过量会使产物中有氢氧化铁生成,提高纯度;
故答案为:碱过量会使产物中有氢氧化铁生成,影响纯度;
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是纸上层析,利用混合物中各组分在两种不同溶剂中的分配系数不同而使物质分离的方法,丙酮对Fe3+的溶解度要大于Cu2+,含有Cu2+和Fe3+的溶液涂在滤纸一端,丙酮作展开剂,在滤纸的毛细作用下,Cu2+和Fe3+沿滤纸纤维向上移动的速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的;
故答案为:纸上层析;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Cu2++4NH3?H2O=Cu(NH3)42++4H2O;
(3)⑤冷却、采用减压过滤,先用冰水洗涤再用乙醇洗涤,洗涤除去晶体表面附着的Na2H2EDTA、氯化物等杂质,乙二胺四乙酸铁钠盐的溶解度受温度影响,它在冰水中的溶解度较小,用冰水洗涤,降低洗涤过程中NaFeEDTA?3H2O的损耗,用乙醇洗涤,乙醇具有挥发性,可以使乙二胺四乙酸铁钠盐快速干燥;
故答案为:用冰水洗涤可降低洗涤过程中NaFeEDTA?3H2O的损耗;用酒精洗涤可使其快速干燥;
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,证明结晶过程出现问题,可能的原因是:步骤④中溶剂蒸发速度快,步骤⑤冷却速率快;
故答案为:步骤④中溶剂蒸发速度快,步骤⑤冷却速率快;
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,溶液中含有Fe3+,检验Fe3+用SCN,故加入的铵盐应为NH4SCN,现象为溶液变为血红色;
故答案为:NH4SCN;
(6)乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,由Na2H2EDTA?2H2O和FeCl3?6H2O发生反应得到,由原子守恒得C10H12FeN2NaO8?3H2O~Na2H2EDTA?2H2O~FeCl3?6H2O,由2.5g(0.009mol)FeCl3?6H2O和3.8g(0.01mol)Na2H2EDTA?2H2O反应,Na2H2EDTA?2H2O过量,故n(C10H12FeN2NaO8?3H2O)=n(FeCl3?6H2O)=0.009mol,理论上制得C10H12FeN2NaO8?3H2O的质量为m=nM=0.009mol×421g/mol=3.789g,实际制得成品2.8g,
NaFeEDTA?3H2O的实际产率=
| 成品质量 |
| 理论质量 |
| 2.8g |
| 3.789g |
故答案为:73.9%.
点评:本题考查了物质的制备,分离,提纯,结晶等操作方法、注意事项以及实际产率的计算,题目难度较大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
从下列各物质的名称上判断其实际成分的说法中正确的是( )
| A、玻璃钢是一种新型的合金材料 | B、钢精锅是用一种优质的铁合金制造的,其耐压性能非常好,可以制成高压锅 | C、暖气管道以及暖气片等表面刷了一层“银粉”,其实质是铝粉 | D、加铁酱油就是在酱油中加入了纳米级别的铁粉 |
 中国疾病预防控制中心的调查显示,中国儿童贫血率在25%左右,妇女贫血率在20%左右,成年男子贫血率则在10%左右.推广铁强化酱油能够控制铁缺乏和缺铁性贫血,改变目前中国人群的缺铁现状.铁强化酱油是在酱油中加入一定量的乙二胺四乙酸铁钠(NaFeEDTA)制成的营养强化调味品.乙二胺四乙酸(EDTA)的结构简式如图所示.下列有关说法不正确的是( )
中国疾病预防控制中心的调查显示,中国儿童贫血率在25%左右,妇女贫血率在20%左右,成年男子贫血率则在10%左右.推广铁强化酱油能够控制铁缺乏和缺铁性贫血,改变目前中国人群的缺铁现状.铁强化酱油是在酱油中加入一定量的乙二胺四乙酸铁钠(NaFeEDTA)制成的营养强化调味品.乙二胺四乙酸(EDTA)的结构简式如图所示.下列有关说法不正确的是( )