网址:http://m.1010jiajiao.com/timu3_id_201132[举报]
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
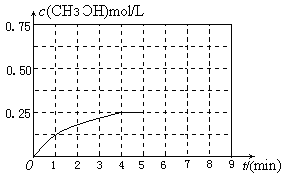
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ) 查看习题详情和答案>>
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)
 CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。

(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.
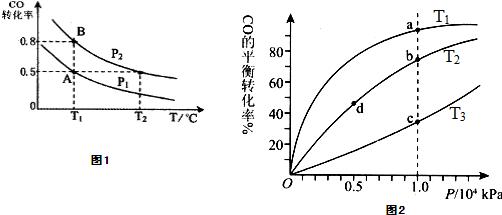
(1)T1℃反应的平衡常数为
(2)图中P1
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式:
据图回答下列问题: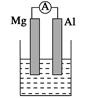
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。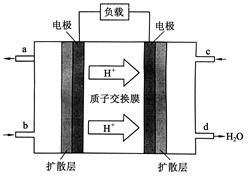
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。
CH3OH(g) ΔH < 0。
原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%- H2% (体积分数) | 03070 | 22870 | 42670 | 82270 | 201070 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转 化率 (%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(1)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:___________________________________________________________
____________________________________________________________________。
为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
| 组别 | 体积分数(%) | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、__________
__________________________________等。
查看习题详情和答案>>