题目内容
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
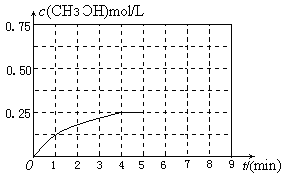
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
(1)2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol
(2)正极:O2+4e-+2CO2=2CO32-
(3)①4;②AB;③如图: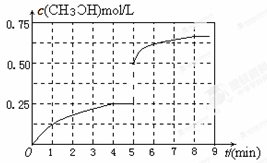
(4)③>④>②>①;cd
解析试题分析:(1)利用盖斯定律,将所给反应I+反应II-反应III可得2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol。
(2)以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,该燃料电池的正极反应为O2+4e-+2CO2=2CO32-。
(3)①根据表格数据(甲组实验),利用三段式可得:
2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
起始浓度(mol/L):1 0.5 0
变化浓度(mol/L):0.5 0.25 0.25
平衡浓度(mol/L):0.5 0.25 0.25
所以平衡常数K=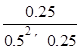 =4;
=4;
②恒温恒容条件下,实验甲和实验乙为等效平衡,甲为从正反应方向进行,乙为从逆反应方向进行,故两种情况下反应物的转化率α1+α2=1,反应放出和吸收的热量数值之和Q1+Q2=d;实验丙反应物是甲的2倍,相当于增大压强,则平衡向正反应方向移动,使反应物转化率增大,α3>α1,平衡时n3>1.0mol,P3<2P1,Q3>2Q1,故选AB。
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,压缩的瞬间,甲醇的浓度为原来的2倍,然后平衡向正反应方向移动,使甲醇浓度进一步增大,直至平衡,据此可作出CH3OH的物质的量浓度的变化曲线图像。
(4)根据题给信息可知甲酸的酸性比乙酸强,故HCOONa溶液比CH3COONa溶液水解程度小,所以四种溶液的pH由大到小的顺序为③>④>②>①;对于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液,根据物料守恒c(HCOOˉ)+c(HCOOH)=" 0.1" mo1/L;电荷守恒为c(HCOOˉ)+ c(OHˉ)=c(Na+)+c(H+),又溶液呈酸性,所以c(H+)>c(OHˉ),故c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ),将物料守恒和电荷守恒联立,可得c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+),综上,cd正确。
考点:考查盖斯定律、燃料电池电极反应式书写、化学平衡、盐类水解等相关知识。

碘与氢气反应的热化学方程式是
①I2(g) + H2(g)  2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1
②I2(s) + H2(g)  2HI(g) ΔH =" +26.48" kJ·mol-1
2HI(g) ΔH =" +26.48" kJ·mol-1
下列说法正确的是( )
| A.①的产物比②的产物稳定 |
| B.I2(s) = I2(g) ΔH=" +17.00" kJ·mol-1 |
| C.②的反应物总能量比①的反应物总能量低 |
| D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ |
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
②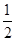 H2(g)+
H2(g)+ 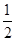 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+ 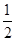 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
(14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正=" v" (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
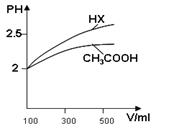
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO?)-c(Na+)=_________mol·L-1(填精确值)。
 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的 。请回答下问题;
。请回答下问题;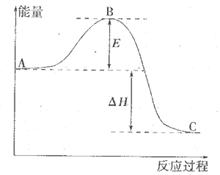
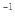 ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。 AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。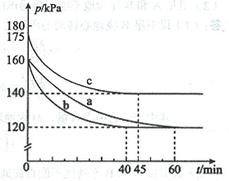
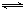 2NO(g) △H= 。
2NO(g) △H= 。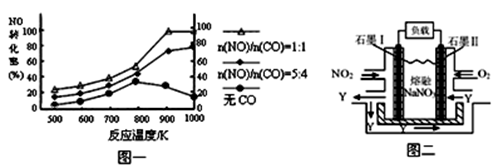
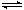 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。