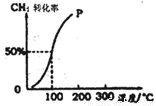
题目内容
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.
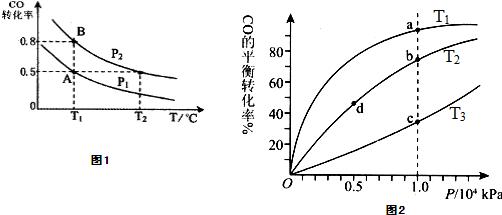
(1)T1℃反应的平衡常数为
(2)图中P1
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式:
分析:(1)T1℃利用A点时CO的转化率,结合化学平衡常数表达式,计算化学平衡常数;
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
(3)A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(4)平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
(5)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快;b、d两点压强相同,温度越高,反应速率越大;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,K值增大.平衡常数只与温度有关,b、d两点温度相同,平衡常数相同;
D.CO转化率的越大,n总越小,由M=
,判断;
(6)利用盖斯定律,消去两个热化学方程式中的CO,可得到答案;
(7)该燃料电池负极发生氧化反应,则1molCH3OH失去电子,转化为CO2,共失去6mole-,电解质溶液中含有CO32-,得到电极反应式.
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
(3)A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(4)平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
(5)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快;b、d两点压强相同,温度越高,反应速率越大;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,K值增大.平衡常数只与温度有关,b、d两点温度相同,平衡常数相同;
D.CO转化率的越大,n总越小,由M=
| m |
| n |
(6)利用盖斯定律,消去两个热化学方程式中的CO,可得到答案;
(7)该燃料电池负极发生氧化反应,则1molCH3OH失去电子,转化为CO2,共失去6mole-,电解质溶液中含有CO32-,得到电极反应式.
解答:解:(1)T1℃利用A点时CO的转化率为50%,则CO转化的物质的量浓度为:
×50%=0.25mol/L,H2、CH3OH转化的物质的量浓度分别为:0.5mol/L、0.25mol/L,平衡时,CO、H2、CH3OH浓度分别为:0.25mol/L、
-0.5mol/L=0.5mol/L、0.25mol/L,K=
=4 L2?mol-2,故答案为:4 L2?mol-2;
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中P2转化率大于P1,可知P1<P2,故答案为:<;
(3)A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=
=4,V=4L,
故答案为:4;
(4)CO(g)+2H2(g)?CH3OH(g),
A.CO的含量保持不变,说明反应达到平衡,故A正确;
B.容器中CH3OH浓度与CO浓度相等,与消耗量和起始量有关反应不一定达到平衡,故B错误;
C.反应速率之比等于化学方程式系数之比是正反应速率之比,2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2)说明V正(H2)=V逆(H2)说明反应达到平衡,故C正确;
D.混合气体质量不变,反应前后体积不同,反应过程中密度变化,容器中混合气体的密度保持不变说明反应达到平衡,故D正确;
故答案为:ACD;
(5)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A正确;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C错误;
D.CO转化率的越大,n总越小,由M=
,可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误;
故选A;
(6)利用盖斯定律,消去两个热化学方程式中的CO,可得到答案,写出热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1;
(7)该燃料电池负极发生氧化反应,则甲醇失去电子,用电解质溶液中的CO32-,得到电极反应式:CH3OH-6e-+3CO32-=4CO2+2H2O,故答案为:CH3OH-6e-+3CO32-=4CO2+2H2O.
| 10mol |
| 20L |
| 20mol |
| 20L |
| 0.25mol/L |
| 0.25mol/L×(0.5mol/L)2 |
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中P2转化率大于P1,可知P1<P2,故答案为:<;
(3)A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=
| ||||
|
故答案为:4;
(4)CO(g)+2H2(g)?CH3OH(g),
A.CO的含量保持不变,说明反应达到平衡,故A正确;
B.容器中CH3OH浓度与CO浓度相等,与消耗量和起始量有关反应不一定达到平衡,故B错误;
C.反应速率之比等于化学方程式系数之比是正反应速率之比,2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2)说明V正(H2)=V逆(H2)说明反应达到平衡,故C正确;
D.混合气体质量不变,反应前后体积不同,反应过程中密度变化,容器中混合气体的密度保持不变说明反应达到平衡,故D正确;
故答案为:ACD;
(5)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A正确;
B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c).b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;
C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C错误;
D.CO转化率的越大,n总越小,由M=
| m |
| n |
故选A;
(6)利用盖斯定律,消去两个热化学方程式中的CO,可得到答案,写出热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1;
(7)该燃料电池负极发生氧化反应,则甲醇失去电子,用电解质溶液中的CO32-,得到电极反应式:CH3OH-6e-+3CO32-=4CO2+2H2O,故答案为:CH3OH-6e-+3CO32-=4CO2+2H2O.
点评:本题考查盖斯定律,图象分析以及三段式计算的应用等,考查范围广,难度中等,对于化学平衡状态的判断和电极反应式是高考的热点,能够熟练应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.

 CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
CO(g)+3H2(g)
△H=+206.0kJ•molˉ1