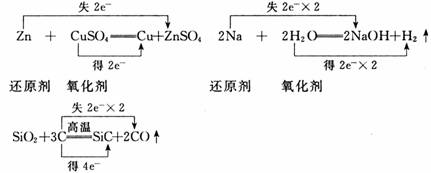
摘要:28.请用“双线桥 法分析下列氧化还原反应 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑ + 4H2O 此反应中氧化剂是 . 还原剂是 .当生成1mol NO时转移的电子数为 . ‚2K2S + K2SO3 + 3H2SO4 == 3K2SO4 + 3S↓ + 3H2O 此反应中的氧化剂是 .氧化产物是 .氧化产物与还原产物的物质的量之比为 .
网址:http://m.1010jiajiao.com/timu3_id_201087[举报]
(1)用单线桥表示下列反应中电子转移的方向和数目,并填空2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
反应中若有71克Cl2生成,转移的电子数为______个.
(2)请用“双线桥”法分析下列氧化还原反应中电子转移的方向和数目,并填空2K2S+K2SO3+3H2SO4=3K2SO4+3S↓+3H2O
氧化产物与还原产物的物质的量之比为______.
(3)已知离子反应:RO3-+6I-+6H+═Rn-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒,得失电子守恒”等判断:n=______,R元素在RO中的化合价是______.
(4)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的______.
查看习题详情和答案>>
用双线桥法分析下列氧化还原反应,指明化合价升降,电子得失和被氧化、被还原的情况。
(1)2FeCl3+H2S=2FeCl2+S↓+2HCl
(2)KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(3)FeS+4HNO3=Fe(NO3)3+S↓+NO↑+2H2O 查看习题详情和答案>>
(1)2FeCl3+H2S=2FeCl2+S↓+2HCl
(2)KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(3)FeS+4HNO3=Fe(NO3)3+S↓+NO↑+2H2O 查看习题详情和答案>>
回答下列有关氧化还原反应的问题:
(1)在下列反应中:A.2F2+2H2O=4HF+O2↑;
B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2;D.2H2O
2H2↑+O2↑.其中水只是氧化剂的是
(2)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+2FeCl3═CuCl2+2FeCl2
①请用双线桥法在上式中标出电子转移的情况
②试比较Fe3+、Cu2+、Fe2+氧化性的强弱:
查看习题详情和答案>>
(1)在下列反应中:A.2F2+2H2O=4HF+O2↑;
B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2;D.2H2O
| ||
B
B
,水只是还原剂的是A
A
,水既是氧化剂,又是还原剂的是D
D
,水既不是氧化剂,又不是还原剂的是C
C
(填序号).(2)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+2FeCl3═CuCl2+2FeCl2
①请用双线桥法在上式中标出电子转移的情况
②试比较Fe3+、Cu2+、Fe2+氧化性的强弱:
Fe3+
Fe3+
>Cu2+
Cu2+
>Fe2+
Fe2+
.