摘要:2. 在NaCl.Cl2.( ).NaClO2.NaClO3的排列中.括号内填入的物质的化学式应为 A.NaClO4 B.HCl C.NaClO D.ClO2
网址:http://m.1010jiajiao.com/timu3_id_200900[举报]
(2011?丰台区一模)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水.某同学想在实验室探究Cl2性质并模拟制备漂水,如图是部分实验装置.已知KMnO4与盐酸溶液反应可以制取Cl2.
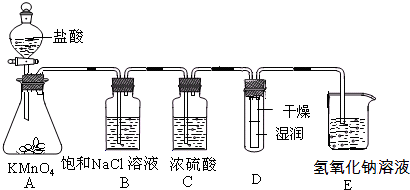
(1)配制物质的量浓度为0.375mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和
(2)浓硫酸的作用是
(3)装置E中发生化学反应的离子方程式为
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明)
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的.请判断该解释是否合理
(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为
查看习题详情和答案>>

(1)配制物质的量浓度为0.375mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和
容量瓶
容量瓶
.(2)浓硫酸的作用是
干燥氯气
干燥氯气
.(3)装置E中发生化学反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明)
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
.(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的.请判断该解释是否合理
不合理
不合理
,并分析产生上述实验现象的原因实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
;如需改进,请简述设计方案取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
(若认为合理.则此问可不作答).(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为
0.5
0.5
mol. (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥有色布条无明显变化,潮湿有色布条褪色
干燥有色布条无明显变化,潮湿有色布条褪色
.(2)为防止氯气尾气污染空气,根据氯气的性质,可用
氢氧化钠
氢氧化钠
溶液吸收多余的氯气,原理是(用化学方程式表示)2NaOH+Cl2=NaClO+NaCl+H2O
2NaOH+Cl2=NaClO+NaCl+H2O
.根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式),长期露置于空气中的漂白粉会失效的原因,用化学反应方程式可表示为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.(3)在某防空防灾演习现场,模拟一起大客车与一辆装有氯气的槽罐车发生追尾事故,造成槽罐翻落、氯气泄露.人防办立即指挥专业救援队在事发地点,测定风向,进行事故处置.
①引导大客车上的乘客
c
c
(填序号);a.顺风向高处转移 b.顺风向低处转移
c.逆风向高处转移 d.逆风向低处转移
②指导附近居民用浸透以下某种物质的毛巾捂住口鼻,离开事故现场,这种物质可能是
a
a
(填序号).a.Na2CO3 b.NaOH c.NaCl d.NaClO
③消防队员将翻落的氯槽罐移至附近的水坑中,请用化学方程式表示氯槽罐被移至水中的原因
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.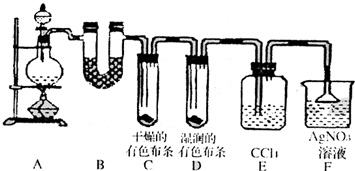 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)下列方法中,可制得氯气的正确组合是
D
D
.①MnO2和浓盐酸混合共热②MnO2、NaCl和浓硫酸混合共热
③次氯酸钠和浓盐酸混合④K2Cr2O7和浓盐酸混合
⑤KClO3和浓盐酸混合共热⑥KMnO4和浓盐酸混合
A.①②⑥;B.②④⑥;C.①④⑥;D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
(3)①装置B的作用是
证明有水蒸气产生
证明有水蒸气产生
,现象是白色固体变蓝色
白色固体变蓝色
.②装置C和D出现的不同现象说明的问题是
干燥氯气无漂白性,次氯酸有漂白性
干燥氯气无漂白性,次氯酸有漂白性
.③装置E的作用是
吸收氯气
吸收氯气
.④写出装置F中发生反应的离子方程式
Ag-+Cl-═AgCl↓
Ag-+Cl-═AgCl↓
.(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
E
E
与F
F
之间(填装置字母序号),装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)
湿润的淀粉KI试纸(或湿润的有色布条)
. (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
(1)t1前,氧化产物是
Ca(ClO)2
Ca(ClO)2
(填化学式).(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
.(3)该石灰乳中含有Ca(OH)2的物质的量是
5
5
mol.(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是
D
D
(填字母).A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
2
2
Fe(OH)3+(5-n)
(5-n)
ClO-+2n
2n
OH-----2
2
Fe| O | n- 4 |
(5-n)
(5-n)
Cl-+(n+3)
(n+3)
H2O.