题目内容
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥有色布条无明显变化,潮湿有色布条褪色
干燥有色布条无明显变化,潮湿有色布条褪色
.(2)为防止氯气尾气污染空气,根据氯气的性质,可用
氢氧化钠
氢氧化钠
溶液吸收多余的氯气,原理是(用化学方程式表示)2NaOH+Cl2=NaClO+NaCl+H2O
2NaOH+Cl2=NaClO+NaCl+H2O
.根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式),长期露置于空气中的漂白粉会失效的原因,用化学反应方程式可表示为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.(3)在某防空防灾演习现场,模拟一起大客车与一辆装有氯气的槽罐车发生追尾事故,造成槽罐翻落、氯气泄露.人防办立即指挥专业救援队在事发地点,测定风向,进行事故处置.
①引导大客车上的乘客
c
c
(填序号);a.顺风向高处转移 b.顺风向低处转移
c.逆风向高处转移 d.逆风向低处转移
②指导附近居民用浸透以下某种物质的毛巾捂住口鼻,离开事故现场,这种物质可能是
a
a
(填序号).a.Na2CO3 b.NaOH c.NaCl d.NaClO
③消防队员将翻落的氯槽罐移至附近的水坑中,请用化学方程式表示氯槽罐被移至水中的原因
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.分析:(1)氯气不具有漂白性,遇到水生成的次氯酸具有强氧化性,使有色物质褪色;
(2)氯气能够和氢氧化钠溶液反应;氯气和氢氧化钠反应方程式;漂白粉的有效成分是次氯酸钙;
醋酸的酸性大于次氯酸的酸性,次氯酸钙中的次氯酸根被碳酸置换出来,次氯酸不稳定,分解产生氯气和水;
(3)①氯气密度比空气的大;②所选物质,既能与氯气反应,对人体又不能造成伤害;③氯气和水反应的方程式.
(2)氯气能够和氢氧化钠溶液反应;氯气和氢氧化钠反应方程式;漂白粉的有效成分是次氯酸钙;
醋酸的酸性大于次氯酸的酸性,次氯酸钙中的次氯酸根被碳酸置换出来,次氯酸不稳定,分解产生氯气和水;
(3)①氯气密度比空气的大;②所选物质,既能与氯气反应,对人体又不能造成伤害;③氯气和水反应的方程式.
解答:解:(1)第一个瓶内,氯气和布条都是干燥的,无法产生次氯酸,布条没有什么变化;第二个瓶内布条放入中,氯气能够和水反应生成次氯酸,次氯酸使有色布条褪色,故答案为:干燥有色布条无明显变化,潮湿有色布条褪色;
(2)氯气可以与碱溶液反应,生成氯化钠和次氯酸钠,使有毒氯气转化成无毒物质,所以常用氢氧化钠溶液吸收多余的氯气,
氯气与氢氧化钠反应方程式为:2NaOH+Cl2=NaClO+NaCl+H2O,
氯气与氢氧化钙反应,生成氯化钙和次氯酸钙,其中漂白粉的有效成分是次氯酸钙,
由于碳酸的酸性大于次氯酸的,长期露置于空气中的漂白粉,会发生反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,次氯酸不稳定,容易分解,
故答案为:氢氧化钠(NaOH);2NaOH+Cl2=NaClO+NaCl+H2O;Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)①由于氯气密度大于空气密度,应该选择逆风高处,故答案为:c;
②四种物质中,c、d不与氯气反应,b具有很强的腐蚀性,只有a就可以反应,有对人无伤害,故答案为:a;
③氯气与水反应的方程式为:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO.
(2)氯气可以与碱溶液反应,生成氯化钠和次氯酸钠,使有毒氯气转化成无毒物质,所以常用氢氧化钠溶液吸收多余的氯气,
氯气与氢氧化钠反应方程式为:2NaOH+Cl2=NaClO+NaCl+H2O,
氯气与氢氧化钙反应,生成氯化钙和次氯酸钙,其中漂白粉的有效成分是次氯酸钙,
由于碳酸的酸性大于次氯酸的,长期露置于空气中的漂白粉,会发生反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,次氯酸不稳定,容易分解,
故答案为:氢氧化钠(NaOH);2NaOH+Cl2=NaClO+NaCl+H2O;Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)①由于氯气密度大于空气密度,应该选择逆风高处,故答案为:c;
②四种物质中,c、d不与氯气反应,b具有很强的腐蚀性,只有a就可以反应,有对人无伤害,故答案为:a;
③氯气与水反应的方程式为:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO.
点评:本题考查探究氯气、氯水的漂白性,氯气的化学性质,题量较大,涉及内容较多,难度适中.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是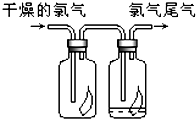 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是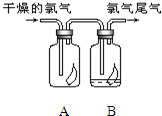 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是