摘要:10.实验室配制100mL1.0mol·L-1的NaCl溶液有如下操作步骤: ①把称量好的NaCl固体放入小烧杯中.加适量蒸馏水溶解, ②把①所得溶液小心转入100mL容量瓶中, ③将容量瓶塞紧.充分摇匀, ④继续向容量瓶中加蒸馏水至离液面刻度相距1cm-2cm处.改用胶头滴管小心滴加至蒸馏水凹液面与刻度线相切, ⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次.每次洗涤的液体都小心转入容量瓶中.并轻轻摇匀. 请填写下列空白: (1)操作步骤正确的顺序为 . (2)实验中用到的玻璃仪器有 . (3)若出现如下情况.对所配溶液浓度的影响是(填“偏高 .“偏低 或“无影响 ). a.没有进行操作步骤⑤ , b.开始时容量瓶没有干燥 . (4)其实验过程中出现如下情况应如何处理? a.定容时加蒸馏水不慎超过了刻度线: , b.向容量瓶中转移溶液时不慎有液滴外溅: . 探究拓展: 11.将标准状况下的aLHCl溶于1000g水中.得到的盐酸密度为bg·cm-3.则该盐酸的物质的量浓度是 ( ) A. B. C. D.
网址:http://m.1010jiajiao.com/timu3_id_198613[举报]
实验室要配制100mL1.0mol?L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体
(2)若用NaCl固体配制溶液除需用烧杯、玻璃棒、药匙、托盘天平、洗瓶外还需要用到的玻璃仪器有
(3)容量瓶上除刻度线外还应标有
(4)下列四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转入容量瓶中就直接进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线.
查看习题详情和答案>>
(1)经计算,应该用托盘天平称取NaCl固体
5.9
5.9
g.(2)若用NaCl固体配制溶液除需用烧杯、玻璃棒、药匙、托盘天平、洗瓶外还需要用到的玻璃仪器有
100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
.(3)容量瓶上除刻度线外还应标有
温度
温度
、容积
容积
,使用容量瓶前第一步要检漏
检漏
.(4)下列四项错误操作会导致所得溶液浓度偏高的是
B
B
(填序号).A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转入容量瓶中就直接进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线.
实验室要配制100mL1.0mol?L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是
A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F.托盘天平 G.洗瓶
(3)若要实施配制,除上述仪器外,尚缺的仪器或用品是
(4)容量瓶上除有刻度线外还应标有
(5)配制过程有以下操作:A.移液;B.称量; C.洗涤;D.定容;E.溶解; F.摇匀
其正确的操作顺序应是
(6)下列四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
查看习题详情和答案>>
(1)经计算,应该用托盘天平称取NaCl固体
5.9
5.9
g.(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是
AB
AB
.(填序号)A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F.托盘天平 G.洗瓶
(3)若要实施配制,除上述仪器外,尚缺的仪器或用品是
玻璃棒
玻璃棒
、100mL容量瓶
100mL容量瓶
.(4)容量瓶上除有刻度线外还应标有
温度
温度
、容量
容量
,在使用前必须检查容量瓶是否漏水
漏水
.(5)配制过程有以下操作:A.移液;B.称量; C.洗涤;D.定容;E.溶解; F.摇匀
其正确的操作顺序应是
B、E、A、C、(A)、D、F
B、E、A、C、(A)、D、F
. (填序号).(6)下列四项错误操作会导致所得溶液浓度偏高的是
B
B
(填序号).A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4?7H2O晶体及金属Cu.
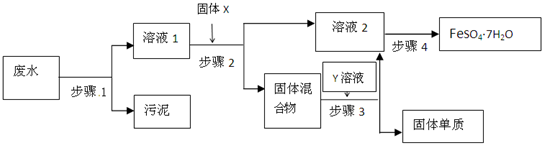
(1)步骤1的主要操作是
(2)步骤2中发生反应的离子方程式为
(3)步骤3中加入的Y溶液是
(4)步骤4中涉及的操作是:蒸发浓缩.
(5)实验室要配制100mL1.0mol?L-1 FeSO4溶液,经计算,应该用托盘天平称取FeSO4?7H2O固体
查看习题详情和答案>>

(1)步骤1的主要操作是
过滤
过滤
,需用到的玻璃仪器有烧杯
烧杯
,普通漏斗
普通漏斗
、玻璃棒
玻璃棒
.(2)步骤2中发生反应的离子方程式为
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
;(3)步骤3中加入的Y溶液是
H2SO4
H2SO4
(填化学式);(4)步骤4中涉及的操作是:蒸发浓缩.
冷却结晶
冷却结晶
.过滤.洗涤.烘干.(5)实验室要配制100mL1.0mol?L-1 FeSO4溶液,经计算,应该用托盘天平称取FeSO4?7H2O固体
27.8
27.8
g.
