题目内容
已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4?7H2O晶体及金属Cu.
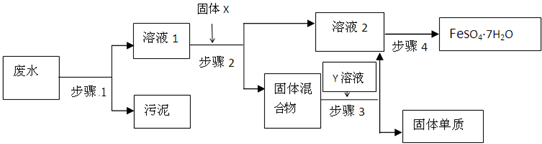
(1)步骤1的主要操作是
(2)步骤2中发生反应的离子方程式为
(3)步骤3中加入的Y溶液是
(4)步骤4中涉及的操作是:蒸发浓缩.
(5)实验室要配制100mL1.0mol?L-1 FeSO4溶液,经计算,应该用托盘天平称取FeSO4?7H2O固体

(1)步骤1的主要操作是
过滤
过滤
,需用到的玻璃仪器有烧杯
烧杯
,普通漏斗
普通漏斗
、玻璃棒
玻璃棒
.(2)步骤2中发生反应的离子方程式为
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
;(3)步骤3中加入的Y溶液是
H2SO4
H2SO4
(填化学式);(4)步骤4中涉及的操作是:蒸发浓缩.
冷却结晶
冷却结晶
.过滤.洗涤.烘干.(5)实验室要配制100mL1.0mol?L-1 FeSO4溶液,经计算,应该用托盘天平称取FeSO4?7H2O固体
27.8
27.8
g.分析:工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,首先通过步骤1进行过滤除去污泥,在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体.
解答:解:(1)步骤1为不溶性固体和溶液的分离,应为过滤操作,需要的玻璃仪器有烧杯、玻璃棒、普通漏斗,
故答案为:过滤;烧杯;普通漏斗;玻璃棒;
(2)在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,以制得单质Cu,故答案为:Fe+Cu2+═Cu+2Fe2+;
(3)经步骤2后所得固体混合物为Fe和Cu的混合物,过量的Fe用稀H2SO4除去,发生反应为Fe+H2SO4═FeSO4+H2↑,
故答案为:H2SO4;
(4)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,故答案为:冷却结晶;
(5)n(FeSO4)=0.1L×1.0mol/L=0.1mol,n(FeSO4?7H2O)=n(FeSO4)=0.1mol,
m(FeSO4?7H2O)=0.1mol×278g/mol=27.8g,
故答案为:27.8.
故答案为:过滤;烧杯;普通漏斗;玻璃棒;
(2)在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,以制得单质Cu,故答案为:Fe+Cu2+═Cu+2Fe2+;
(3)经步骤2后所得固体混合物为Fe和Cu的混合物,过量的Fe用稀H2SO4除去,发生反应为Fe+H2SO4═FeSO4+H2↑,
故答案为:H2SO4;
(4)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,故答案为:冷却结晶;
(5)n(FeSO4)=0.1L×1.0mol/L=0.1mol,n(FeSO4?7H2O)=n(FeSO4)=0.1mol,
m(FeSO4?7H2O)=0.1mol×278g/mol=27.8g,
故答案为:27.8.
点评:本题考查物质的分离和提纯,题目难度不大,注意根据物质的性质选择分离提纯的方法,特别是过滤和蒸发结晶操作,注意把握所使用仪器和操作步骤.

练习册系列答案
相关题目

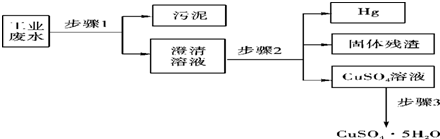
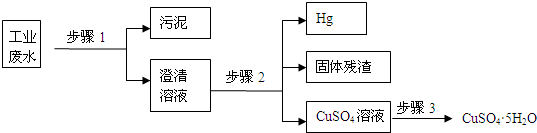
 已知某工业废水中含有N
已知某工业废水中含有N