摘要:7.在标准状况下aL HCl气体溶于100g水中.得到的溶液密度为bg·cm-3.则盐酸的质量分数是 .物质的量浓度是 . 强化演练场 盛悟理解:
网址:http://m.1010jiajiao.com/timu3_id_198604[举报]
将标准状况下aL HCl气体溶于1000 g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度为 ( )
A. mol·L-1 B.
mol·L-1
C. mol·L-1 D.
mol·L-1
查看习题详情和答案>>
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:(1)A与E形成的化合物的化学式是
Al2O3
Al2O3
.(2)B的最高价氧化物化学式为
P2O5
P2O5
,C在周期表中的位置是第三周期第ⅥA族
第三周期第ⅥA族
,C的元素名称为硫
硫
,D的单质与水反应的方程式为Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.(3)向D与E形成的化合物的水溶液中逐渐滴入烧碱溶液直至过量,观察到的现象是
先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O
Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O
.回答下列问题:
(1)
S2-微粒中的中子数是 ,核外电子数是 .若阿伏加德罗常数用NA表示,49.5g 34SO2含有 个原子.S原子的结构示意图 .
(2)3.01×1023个HCl分子的物质的量是 mol,其在标准状况下的体积为 L,将其溶于水配成2L溶液,所得溶液的物质的量浓度为 mol/L.
(3)在工农业生产和日常生活中经常用到下列物质:①Si;②Ca(ClO)2;③Al(OH)3;④Fe2O3.其中,可用于制造芯片的是 (填序号,下同);可用于杀菌,消毒的是 ;可用作红色油漆和涂料的是 ;医疗上可用作胃酸中和剂的是 .
查看习题详情和答案>>
(1)
34 16 |
(2)3.01×1023个HCl分子的物质的量是
(3)在工农业生产和日常生活中经常用到下列物质:①Si;②Ca(ClO)2;③Al(OH)3;④Fe2O3.其中,可用于制造芯片的是
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4; 1molA的单质能跟盐酸反应,在标准状况下可置换出11.2L的H2,这时A转变为与氖原子具有相同电子层结构的离子.试回答:
(1)A是
(2)B的离子结构示意图是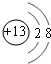
 ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是
(3)A、C元素形成化合物的电子式是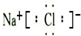
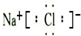 ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是
(4)写出A、B最高正价氧化物对应的水化物之间反应的离子方程式:
查看习题详情和答案>>
(1)A是
Na
Na
元素,B是Al
Al
元素,C是Cl
Cl
元素;(2)B的离子结构示意图是


NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;(3)A、C元素形成化合物的电子式是
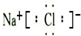
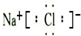
HF
HF
(填氢化物化学式).(4)写出A、B最高正价氧化物对应的水化物之间反应的离子方程式:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.