题目内容
回答下列问题:
(1)
S2-微粒中的中子数是 ,核外电子数是 .若阿伏加德罗常数用NA表示,49.5g 34SO2含有 个原子.S原子的结构示意图 .
(2)3.01×1023个HCl分子的物质的量是 mol,其在标准状况下的体积为 L,将其溶于水配成2L溶液,所得溶液的物质的量浓度为 mol/L.
(3)在工农业生产和日常生活中经常用到下列物质:①Si;②Ca(ClO)2;③Al(OH)3;④Fe2O3.其中,可用于制造芯片的是 (填序号,下同);可用于杀菌,消毒的是 ;可用作红色油漆和涂料的是 ;医疗上可用作胃酸中和剂的是 .
(1)
34 16 |
(2)3.01×1023个HCl分子的物质的量是
(3)在工农业生产和日常生活中经常用到下列物质:①Si;②Ca(ClO)2;③Al(OH)3;④Fe2O3.其中,可用于制造芯片的是
分析:(1)根据元素符号的含义,质子数+中子数=质量数,阴离子的电子数=质子数+电荷数;依据n=
计算物质的量结合分子中含有的原子数目来计算;根据核外电子层排布,画出原子的结构示意图;
(2)根据n=
=
=C?V(溶液)计算;
(3)Si可做为半导体,可以有很多特殊的功能;Ca(ClO)2中+1价的氯具有强氧化性;Al(OH)3具有两性;Fe2O3是氧化物,颜色为红棕色,据此即可解答.
| m |
| M |
(2)根据n=
| N |
| NA |
| V |
| Vm |
(3)Si可做为半导体,可以有很多特殊的功能;Ca(ClO)2中+1价的氯具有强氧化性;Al(OH)3具有两性;Fe2O3是氧化物,颜色为红棕色,据此即可解答.
解答:解:(1)
S2-微粒的质子数为16,质量数为34,中子数=34-16=18,核外电子数=16+2=18;
49.5g 34SO2的物质的量为
=0.75mol,1个34SO2中含有3个原子,所以有49.5g 34SO2含有2.25NA个原子;
硫原子的结构示意图为: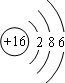 ;
;
故答案为:18;18;2.25NA; ;
;
(2)解:HCl分子的物质的量n(HCl)=
=
=0.5mol,在标准状况下的体积其体积V(HCl)=0.5mol×22.4L/mol=11.2L,将其溶于水配成2L溶液,所得溶液的物质的量浓度为
c(HCl)=
=0.25mol/L,
故答案为:0.5;11.2;0.25;
(3)①Si原子最外层电子为4个,既难得电子,也难失去电子,可做为半导体,可用于制造硅芯片;
②Ca(ClO)2中+1价的氯具有强氧化性,能与还原性物质作用变成-1价的氯,可用于杀菌、消毒;
③Al(OH)3具有两性,作为酸时,酸性较弱,作为碱时,碱性较弱,胃酸的成分为盐酸,氢氧化铝显弱碱性,和盐酸发生中和反应,Al(OH)3医疗上可用作胃酸中和剂;
④Fe2O3是氧化物,颜色为红棕色,俗称为铁红,可用作红色油漆和涂料;
故答案为:①;②;④;③;
34 16 |
49.5g 34SO2的物质的量为
| 49.5g |
| 66g/mol |
硫原子的结构示意图为:
 ;
;故答案为:18;18;2.25NA;
 ;
;(2)解:HCl分子的物质的量n(HCl)=
| N |
| NA |
| 3.01×1023 |
| 6.02×1023/mol |
c(HCl)=
| 0.5mol |
| 2L |
故答案为:0.5;11.2;0.25;
(3)①Si原子最外层电子为4个,既难得电子,也难失去电子,可做为半导体,可用于制造硅芯片;
②Ca(ClO)2中+1价的氯具有强氧化性,能与还原性物质作用变成-1价的氯,可用于杀菌、消毒;
③Al(OH)3具有两性,作为酸时,酸性较弱,作为碱时,碱性较弱,胃酸的成分为盐酸,氢氧化铝显弱碱性,和盐酸发生中和反应,Al(OH)3医疗上可用作胃酸中和剂;
④Fe2O3是氧化物,颜色为红棕色,俗称为铁红,可用作红色油漆和涂料;
故答案为:①;②;④;③;
点评:本题考查了核素中各微粒间的关系,物质的量的相关计算,元素及其化合物的知识,题目难度不大,侧重考查学生的辨别能力和归纳能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
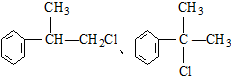
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成


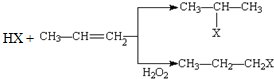 (X为卤素原子)
(X为卤素原子)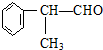 的物质,该物质是一种香料.
的物质,该物质是一种香料.