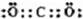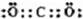网址:http://m.1010jiajiao.com/timu3_id_194078[举报]
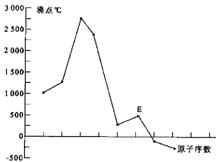
原子序数依次增大的A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
化合物 | 甲 | 乙 |
原子个数比 | B∶A=1∶4 | C∶A=1∶3 |
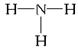
(1)元素E的基态原子的电子排布式为________________________。
(2)写出化合物乙的结构式__________________,该分子中C的原子轨道发生的是____________杂化。
(3)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到8电子稳定结构,则X的化学式为__________________。
(4)D在F中燃烧的产物属于______________晶体,其晶体中与D+最近且等距离的F-有___________个。
查看习题详情和答案>>[化学——选修物质结构与性质]
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,![]() 比
比![]() 少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
 甲、乙两种分子,且两种
甲、乙两种分子,且两种
分子中各原子的个数见下表:
| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(1)元素F的基态原子的电子排布式为 。
(2)分子甲的空间构型为 ,该分子中B的
原子轨道发生的是 杂化。
(3)E单质属于 晶体,E与A元素形成 分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于 晶体,其晶体中与![]() 最近且等距离的
最近且等距离的![]() 有 个。
有 个。
(5)C元素的第一电离能(![]() ) 氧元素的第一电离能(
) 氧元素的第一电离能(![]() )(填“<”或“>”或“=”)。
)(填“<”或“>”或“=”)。
(1)实验室中可用下图A或B装置与相应的药品制得丙.
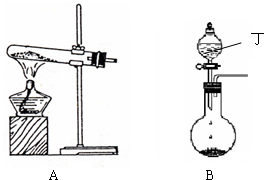
①A中试管内反应的化学方程式是
| ||
| ||
②B中分液漏斗内盛放的物质丁是
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
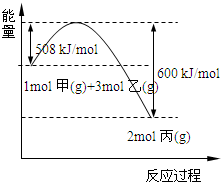
该反应的热化学方程式是
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
| ||
| ||
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
| 元素 | 相关信息 |
| X | X元素在空气中含量最高 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同主族,原子半径:Y>Z |
| W | W元素的一种氧化物具有磁性 |
| H | H元素形成的盐溶液一般呈蓝色 |
(1)下列选项中能作为判断Y和Z 的非金属性强弱的依据有(填字母编号)
a.Y和Z的单质的熔点高低
b.Y和Z的氢化物的稳定性强弱
c.Y和Z的氢化物的沸点高低
d.Y和Z的最高价氧化物对应的水化物的酸性强弱
(2)用电子式表示X的最简单氢化物的形成过程
(3)Y元素在元素周期表中的位置为
(4)取100mL1mol/L(3)中 A的溶液,加入W单质和H单质的混合物粉末共6g充分搅拌后,固体完全溶解,往反应后溶液中加入KSCN溶液,无明显现象.则混合物粉末中W单质的质量分数为
(5)取100mL物质的量浓度均为1mol/L的X的最高价含氧酸和Y的最高价含氧酸的混合稀溶液,加入足量H单质的粉末充分搅拌,最多能溶解该粉末
(1)C位于元素周期表第
| ||
| ||
(2)A、B、C三种元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序是
(3)C的单质通入B的氢化物水溶液中,产生的实验现象是
(4)写出化合物AD2的电子式