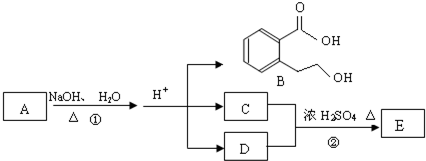
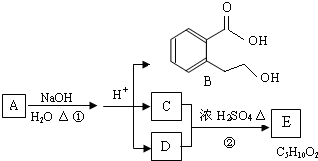
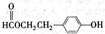题目内容
A、B、C、D、E均为短周期元素,其中A是形成化合物最多的元素;常温常压下,B元素形成的单质是淡黄色固体,常在火山口附近沉积;C和B同周期,且C的电负性大于B;D元素在地壳中含量最多;E元素的单质在空气中含量最多.
(1)C位于元素周期表第
(2)A、B、C三种元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序是
(3)C的单质通入B的氢化物水溶液中,产生的实验现象是
(4)写出化合物AD2的电子式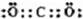
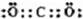 ,一种由D、E组成的化合物与AD2互为等电子体,其化学式为
,一种由D、E组成的化合物与AD2互为等电子体,其化学式为
(1)C位于元素周期表第
三
三
周期第ⅤⅡA
ⅤⅡA
族;合成E元素氢化物的工业反应化学方程式是H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(2)A、B、C三种元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序是
HClO4>H2SO4>H2CO3
HClO4>H2SO4>H2CO3
(用相应酸的分子式表示).(3)C的单质通入B的氢化物水溶液中,产生的实验现象是
乳白色沉淀
乳白色沉淀
,发生反应的化学方程式Cl2+H2S═2HCl+S↓
Cl2+H2S═2HCl+S↓
.(4)写出化合物AD2的电子式
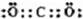
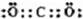
N2O
N2O
.分析:A是形成化合物最多的元素,A为C;B元素形成的单质是淡黄色固体,B为S;C和B同周期,且C的电负性大于B,则C为Cl;D元素在地壳中含量最多,D为O;E元素的单质在空气中含量最多,则E为N,然后结合元素的性质及化学用语来解答.
解答:解:A是形成化合物最多的元素,A为C;B元素形成的单质是淡黄色固体,B为S;C和B同周期,且C的电负性大于B,则C为Cl;D元素在地壳中含量最多,D为O;E元素的单质在空气中含量最多,则E为N,
(1)C为Cl,位于第三周期第ⅤⅡA族,利用H2+Cl2
2HCl合成E的氢化物,故答案为:三;ⅤⅡA;H2+Cl2
2HCl;
(2)非金属性为Cl>S>C,则元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序为HClO4>H2SO4>H2CO3,故答案为:HClO4>H2SO4>H2CO3;
(3)C的单质通入B的氢化物水溶液中发生Cl2+H2S═2HCl+S↓,观察到乳白色沉淀,故答案为:乳白色沉淀;Cl2+H2S═2HCl+S↓;
(4)化合物AD2的电子式为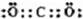 ,由D、E组成的化合物与AD2互为等电子体为N2O,故答案为:
,由D、E组成的化合物与AD2互为等电子体为N2O,故答案为: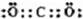 ;N2O.
;N2O.
(1)C为Cl,位于第三周期第ⅤⅡA族,利用H2+Cl2
| ||
| ||
(2)非金属性为Cl>S>C,则元素的最高价氧化物对应水化物的酸性强弱由大到小的顺序为HClO4>H2SO4>H2CO3,故答案为:HClO4>H2SO4>H2CO3;
(3)C的单质通入B的氢化物水溶液中发生Cl2+H2S═2HCl+S↓,观察到乳白色沉淀,故答案为:乳白色沉淀;Cl2+H2S═2HCl+S↓;
(4)化合物AD2的电子式为
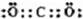 ,由D、E组成的化合物与AD2互为等电子体为N2O,故答案为:
,由D、E组成的化合物与AD2互为等电子体为N2O,故答案为: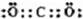 ;N2O.
;N2O.点评:本题考查位置、结构、性质的关系及应用,元素的推断是解答的关键,注意把握元素的性质及单质、化合物的性质即可解答,题目难度中等.

练习册系列答案
相关题目