摘要:Fe2+与Fe3+转化 实验P61科学探究 现象: 结论: 离子方程式: 小结: Fe2+ Fe3+ 写出下列离子方程式.标出电子转移.指出氧化剂.还原剂.氧化产物.还原产物. Fe2++Cl2- Fe2++H2O2+H+- Fe3++Fe- Fe3++I-- Fe3++S2-- 归纳本节课内容: 自我测评
网址:http://m.1010jiajiao.com/timu3_id_193943[举报]
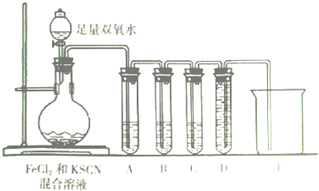 某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:(1)该小组对于产生气体的原因有两种猜测:
猜测一:
猜测二:红色退去可能是SCN- 被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫.
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有
试管B中的溶液是酸性高锰酸钾溶液,其目的是
(3)根据题目信息及以上实验推断,Fe2+ 和SCN-中还原性较强的是
(4)有学生认为SCN- 的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确.
(Ⅰ)一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.
 (1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作
(2)“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
查看习题详情和答案>>
 (1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作还原
还原
剂,过程B中,Fe3+作氧化
氧化
剂.(2)“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作
还原
还原
剂,具有还原
还原
性.(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
FeSO4
FeS+2O2↑
| ||
FeSO4
FeS+2O2↑
;
| ||
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
FeSO4
FeO+SO3↑
| ||
FeSO4
FeO+SO3↑
.
| ||
(2012?海淀区二模)某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化.
(1)该同学最初的实验操作和现象如下:
①实验I的现象为
②FeCl2溶液与新制氯水反应的离子方程式为
(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
根据实验III,甲同学认为Fe33+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由
(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论.请补全下表中的实验方案.
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同.该同学结合上述实验结论,分析了实验III中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为
查看习题详情和答案>>
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| I | 先向2mL 0.1mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| II | 先向2mL 0.1mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色;滴加KI溶液后,红色无明显变化 |
滴加KSCN后溶液无明显变化,加入氯水后溶液变成红色
滴加KSCN后溶液无明显变化,加入氯水后溶液变成红色
.②FeCl2溶液与新制氯水反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| III | 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成红色 |
溶液变成黄色,推测生成了I2
溶液变成黄色,推测生成了I2
.(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论.请补全下表中的实验方案.
| 编号 | 操作 | 预期现象及结论 |
| IV | 向2mL 0.1mol/L KI溶液中滴加1mL0.1mol/L FeCl3溶液, | 预期现象:溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) 预期现象:溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
2Fe3++2I-?2Fe2++I2
2Fe3++2I-?2Fe2++I2
.一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+
Fe3+.在过程A中,Fe2+作
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有
(3)某同学要检验Fe3+,向溶液中加入
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式
(4)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式
(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是
a.铜粉 b.氯气 c.铁粉 d.KSCN溶液.
查看习题详情和答案>>
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+
| A | B |
还原
还原
剂.(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有
还原
还原
性.(3)某同学要检验Fe3+,向溶液中加入
KSCN
KSCN
(写化学式)溶液变成红色.要除去FeCl3溶液中少量的氯化亚铁,可行的办法是c
c
(填字母).a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式
2Fe2++Cl2═2Fe3++2Cl?
2Fe2++Cl2═2Fe3++2Cl?
.(4)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式
2Fe3++Cu2+═2Fe2++Cu2+
2Fe3++Cu2+═2Fe2++Cu2+
.(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是
c
c
(填字母)a.铜粉 b.氯气 c.铁粉 d.KSCN溶液.
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元 素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
⑴人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+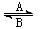 Fe3+。在
Fe3+。在 过程A中,Fe2+作 剂,过程B中,Fe3+作 剂。
过程A中,Fe2+作 剂,过程B中,Fe3+作 剂。
⑵“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作 剂,具有 性。
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为  ;
;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为 ;