题目内容
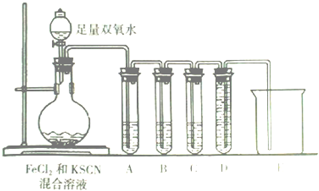 某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:(1)该小组对于产生气体的原因有两种猜测:
猜测一:
猜测二:红色退去可能是SCN- 被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫.
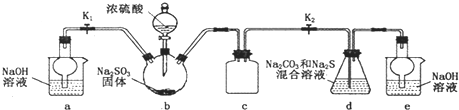
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有
试管B中的溶液是酸性高锰酸钾溶液,其目的是
(3)根据题目信息及以上实验推断,Fe2+ 和SCN-中还原性较强的是
(4)有学生认为SCN- 的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确.
分析:(1)亚铁离子可以被过氧化氢氧化为铁离子,过氧化氢在铁离子的催化作用下发生了分解反应生成了氧气和水;
(2)二氧化硫具有漂白性,可以使品红溶液褪色,酸性高锰酸钾溶液吸收二氧化硫气体,二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳,试管D和烧杯的作用是收集氮气,依据题干所给反应物和产物书写离子方程式.
(3)氧化剂优先氧化还原性强的还原剂,向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应;
(4)硫酸根离子的检验试剂是:先稀盐酸后氯化钡溶液.
(2)二氧化硫具有漂白性,可以使品红溶液褪色,酸性高锰酸钾溶液吸收二氧化硫气体,二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳,试管D和烧杯的作用是收集氮气,依据题干所给反应物和产物书写离子方程式.
(3)氧化剂优先氧化还原性强的还原剂,向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应;
(4)硫酸根离子的检验试剂是:先稀盐酸后氯化钡溶液.
解答:解:(1)亚铁离子可以被过氧化氢氧化为铁离子,过氧化氢在铁离子的催化作用下发生了分解反应生成了氧气和水,
故答案为:氯化亚铁被过氧化氢氧化为氯化铁,在氯化铁的催化作用下过氧化氢分解;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;酸性高锰酸钾溶液除尽二氧化硫气体,因此高锰酸钾溶液过量,所以高锰酸钾溶液颜色变浅;二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳;试管D和烧杯的作用是收集氮气;以上实验证明SCN-能被H2O2氧化的离子方程式为:9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10 H2O,
故答案为:SO2;除尽气体中的SO2,溶液颜色变浅但未褪色;证明气体中还含有CO2;收集生成的N2;9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10 H2O;
(3)向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应,因此还原性较强的是Fe2+,
故答案为:Fe2+;向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应;
(4)硫酸根离子的检验方法为:取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子,
故答案为:取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子.
故答案为:氯化亚铁被过氧化氢氧化为氯化铁,在氯化铁的催化作用下过氧化氢分解;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;酸性高锰酸钾溶液除尽二氧化硫气体,因此高锰酸钾溶液过量,所以高锰酸钾溶液颜色变浅;二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳;试管D和烧杯的作用是收集氮气;以上实验证明SCN-能被H2O2氧化的离子方程式为:9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10 H2O,
故答案为:SO2;除尽气体中的SO2,溶液颜色变浅但未褪色;证明气体中还含有CO2;收集生成的N2;9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10 H2O;
(3)向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应,因此还原性较强的是Fe2+,
故答案为:Fe2+;向FeCl2 和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应;
(4)硫酸根离子的检验方法为:取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子,
故答案为:取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子.
点评:本题考查亚铁离子的还原性,涉及性质实验方案的确定、二氧化硫和二氧化碳性质的比较,氧化还原反应原理和硫酸根离子的检验,综合性很强,难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目