网址:http://m.1010jiajiao.com/timu3_id_193937[举报]
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
查看习题详情和答案>>
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算∶
1.将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁.
(1)钢样中含铁________g.
(2)生成的CO2在标准状况下体积为________mL.
2.向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤.洗涤沉淀,将洗涤液与滤液合并后稀释至250 mL.取25 mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50 mL.计算原溶液中Fe3+的物质的量浓度.
3.铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)].将一块带锈铁片放入700 mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020 g铁.求∶
(1)反应后溶液中溶质的成分与物质的量.
(2)原带锈铁片中铁锈的质量分数.
4.用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示).经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11∶12.已知两种阳离子为Fe2+与Fe3+,物质的量之比为2∶1.请通过计算确定X的化学式.
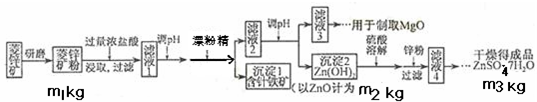
(1)将菱锌矿研磨成粉的目的是
(2)完成加漂粉精反应的离子方程式:
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
(5)“滤液4”之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
 (2010?大连二模)[选修-物质结构与性质]
(2010?大连二模)[选修-物质结构与性质]羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中素.请回答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体为
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl的晶体结构相似(如图所示)①比较晶体熔点的高低MgO
②若在FeO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3.则阿伏伽德罗常数NA表达式为
| 36 |
| da3 |
| 36 |
| da3 |