题目内容
(2011?长宁区模拟)硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
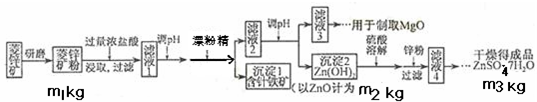
(1)将菱锌矿研磨成粉的目的是
(2)完成加漂粉精反应的离子方程式:
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
(5)“滤液4”之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
.

(1)将菱锌矿研磨成粉的目的是
增大反应物接触面积或增大反应速率或使反应更充分
增大反应物接触面积或增大反应速率或使反应更充分
_,滤液1后两步操作的目是:除去含铁杂质
除去含铁杂质
.(2)完成加漂粉精反应的离子方程式:
2
2
Fe(OH)2+1
1
ClO-
ClO-
+1
1
H2O
H2O
→2
2
Fe(OH)3+1
1
Cl-(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是
FeO(OH)
FeO(OH)
.(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH
Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH
,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH
Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH
(用文字叙述)(5)“滤液4”之后的操作依次为
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤,洗涤,干燥.(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
分析:(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;滤液1中混有Fe3+和Fe2+,调节PH,加入漂白精的目的是将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去;
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,以及Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)利用关系式法来计算质量分数.
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,以及Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)利用关系式法来计算质量分数.
解答:解:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,滤液1中混有Fe3+和Fe2+,调节PH,加入漂白精的目的是将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去,故答案为:增大反应物接触面积或增大反应速率或使反应更充分;除去含铁杂质;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,
故答案为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH)(或其它合理答案);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,故答案为:Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可);
(5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶;
(6)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3 的质量为
ZnCO3 的质量分数为
,故答案为:
.
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,
故答案为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH)(或其它合理答案);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,故答案为:Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可);
(5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶;
(6)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3 的质量为
| 125m2 |
| 81 |
ZnCO3 的质量分数为
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
点评:本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题(过程:情景体现--化学视角--分解解析--问题解决)

练习册系列答案
相关题目
 (2011?长宁区模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2(g)+
(2011?长宁区模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2(g)+