摘要:(一)设计思路 从日常生活中的实例和学生己有的知识出发.用实验直观地比较几种反应的快慢.使学生理解可以从单位时间里反应物浓度的减小或生成物浓度的增加来判断反应进行的快慢.引导学生进行反应速率的简单计算.帮助学生掌握反应速率的表示方法.了解怎样判断反应速率的大小.通探究影响双氧水分解反应速率的因素及生产.生活中相关问题的讨论.帮助学生定性地认识外界条件对化学反应速率的影响.加深对反应速率概念的理解.
网址:http://m.1010jiajiao.com/timu3_id_193348[举报]
 (2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
(2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:方案一:纯碱样品
| 加热 |
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:
加热至恒重,以保证NaHCO3全部分解
加热至恒重,以保证NaHCO3全部分解
.
方案二:纯碱样品溶液
| 氯化钙溶液 |
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:
洗涤沉淀
洗涤沉淀
.(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:
| 106m2 |
| m1 |
| 106m2 |
| m1 |
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际
不变
不变
(填“偏高”、“偏低”或“不变”).方案三:纯碱样品
| 硫酸 |
(1)本实验采用vk图装置,C中盛放的物质是
浓硫酸
浓硫酸
.(2)反应前后都要通入N2,反应后通入N2的目的是:
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收

学习化学应该明确“从生活中来,到生活中去”道理.在生产生活中,我们会遇到各种各样的化学反应.请按要求回答下列问题:
(1)写出下列反应的化学方程式.(注意反应条件并配平)
①镁带着火时,不能用液态CO2灭火剂来灭火的原因是 .
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉 .
(2)请你写出下列反应的离子方程式.
①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多 .
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板 .
(3)工业上生产半导体材料硅的流程如图:
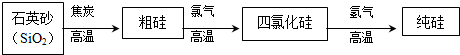
写出在制备粗硅时反应的化学方程式并标出电子转移的方向和数目: .
(4)铝热反应在工业生产中的重要用途之一是 ;小苏打在日常生活中的用途之一是 ,将小苏打和纯碱的混合物19.0g加热到恒重,测得固体质量为15.9g,则混合物中小苏打的质量分数为 .
查看习题详情和答案>>
(1)写出下列反应的化学方程式.(注意反应条件并配平)
①镁带着火时,不能用液态CO2灭火剂来灭火的原因是
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉
(2)请你写出下列反应的离子方程式.
①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板
(3)工业上生产半导体材料硅的流程如图:

写出在制备粗硅时反应的化学方程式并标出电子转移的方向和数目:
(4)铝热反应在工业生产中的重要用途之一是
 脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白
脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白(1)试管A中加入无水冰醋酸,但加热后得不到乙酸乙酯,原因是
(3)试管C中的试剂是
(4)要将乙酸乙酯从C中混和物中分离出来的方法是
(5)试管A中发生反应的化学方程式为: