网址:http://m.1010jiajiao.com/timu3_id_192575[举报]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,与CO互为等电子体的分子和离子有(各写一种): 、 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
③ Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 ,得到新的配合物有 种
④ 配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
 ⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
(3)铜是是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。
⑥ CuH的晶体结构如图所示,该晶体中Cu+的配位数为 。CuH具有许多特殊性质,如易分解、能与水反应、在氯气中燃烧等。写出CuH在氯气中燃烧的化学方程式 。
查看习题详情和答案>>(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
(2)下列比较元素性质的递变规律正确的是
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4 d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
(2)下列比较元素性质的递变规律正确的是______.
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式______.工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式______.
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱______.
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式______.
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______.
(表一)
金属 | 11Na | 12Mg | 13Al |
与水反应程度 |
|
| 不反应 |
最高价氧化物的水化物及其碱性 |
| Mg(OH)2中强碱 |
|
(表二)
非金属 | 14Si | 15P | 16S | 17Cl |
与H2 |
| 高温 | 硫蒸气和H2缓慢化合 |
|
氢化物稳定性 | 极易分解不稳定 | 不稳定 |
|
|
最高价氧化物的水化物及其酸性 |
| H3PO4中强酸 |
|
|
结论:随着原子序数的递增,元素性质呈现______________。
查看习题详情和答案>>学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。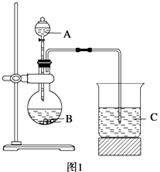
(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
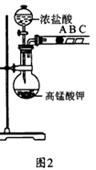
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。