摘要:计算题 在一定温度下发生如下反应:N2(g) + 3H2(g) 2NH3(g) 起始时充入的N2和H2的物质的量分别是3.0mol和6.0mol.平衡时.生成NH3的物质的量是2.4mol.已知容器容积为5.0L.试求: (1)H2的转化率, (2)平衡时混合气体中N2的体积分数. 答案 一 选择题 21(1)搅拌.使混合物充分接触并发生反应 2·8H2O+2NH4Cl== BaCl2+2NH3↑+10H2O (3)玻璃片上结冰(玻璃片与小烧杯粘在一起) 吸热 小于
网址:http://m.1010jiajiao.com/timu3_id_188219[举报]
在真空密闭容器中加入 a mol PH4I固体,在一定温度下发生反应:
PH4I(s) PH3(g )+HI(g),4PH3(g)
PH3(g )+HI(g),4PH3(g) P4(g )+6H2(g),
P4(g )+6H2(g),
2HI(g) H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
求:①平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n (P4)=
6 mol
6 mol,n (PH3)=
mol
mol.
②a、b、c 三者的关系服从 a>
查看习题详情和答案>>
PH4I(s)
 PH3(g )+HI(g),4PH3(g)
PH3(g )+HI(g),4PH3(g) P4(g )+6H2(g),
P4(g )+6H2(g),2HI(g)
 H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.求:①平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n (P4)=
| (d-c) |
| 6 |
| (d-c) |
| 6 |
| (3b+8c-2d) |
| 3 |
| (3b+8c-2d) |
| 3 |
②a、b、c 三者的关系服从 a>
b+2c
b+2c
(填b、c的代数式).向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)?Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 mol/(L?min).
(2)若向达到(1)的平衡体系中充入氩气,则平衡向 (填“左“或“右“或“不移动“);
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率与 (1)的平衡中的X的转化率相比较 .
A.无法确定 B.一定大于 (1)
C.一定等于 (1)D.一定小于 (1)
(4)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 .
查看习题详情和答案>>
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为
(2)若向达到(1)的平衡体系中充入氩气,则平衡向
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率与 (1)的平衡中的X的转化率相比较
A.无法确定 B.一定大于 (1)
C.一定等于 (1)D.一定小于 (1)
(4)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,写出该反应的化学方程式并配平 .若反应过程中转移了0.3mol电子,则氧化产物的质量是 g.
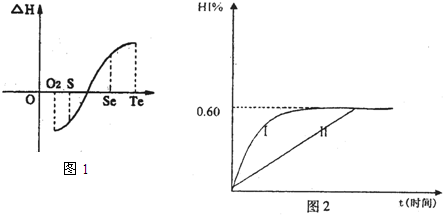
(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质.所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图1所示:
请回答下列问题:
H2与硫化合的反应 热量(填“放出”或“吸收”).根据题目所给信息,请解释为什么Te和H2不能直接化合 .
(3)在复杂的反应中,要考虑反应的先后顺序.已知N
+Al
+2H2O═Al(OH)3↓+NH3?H2O,向含有等物质的量的N
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
第二个离子反应的离子方程式是 .
最后一个离子反应的离子方程式是 .
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+I2(g)?2HI(g),△H<0.并达平衡.HI的体积分数HI%随时问变化曲线如图2所示:
①达到平衡时,I2(g)的物质的量浓度为 mol/L.
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线1所示,则该条件可能是(写出所有的可能性) 在这种条件下,平衡常数K值 (填“增大”、“变小”、“不变”或“可能变大也可能变小”)
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol HI(g),发生反应达到平衡时,H2的体积分数为 .
查看习题详情和答案>>

(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质.所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图1所示:
请回答下列问题:
H2与硫化合的反应
(3)在复杂的反应中,要考虑反应的先后顺序.已知N
| H | + 4 |
| O | - 2 |
| H | + 4 |
第二个离子反应的离子方程式是
最后一个离子反应的离子方程式是
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+I2(g)?2HI(g),△H<0.并达平衡.HI的体积分数HI%随时问变化曲线如图2所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线1所示,则该条件可能是(写出所有的可能性)
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol HI(g),发生反应达到平衡时,H2的体积分数为
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+2B(g)?C(g)+D(g)△H<0,C的体积分数随时间变化如图l中曲线a所示 下列说法正确的是( )
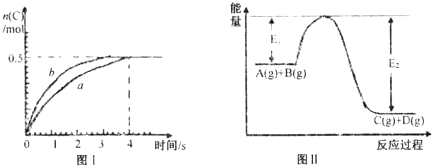

| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
(2013?烟台模拟)硫、氮、碘都是重要的非金属元素.
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=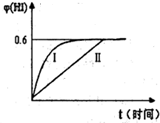
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
查看习题详情和答案>>
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
H2S
H2S
.若反应过程中转移了0.3mol电子,则反应的HNO3的质量是6.3
6.3
g.(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=
-9
-9
kJ?mol-1.
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
0.05
0.05
mol?L-1.②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
AB
AB
(填编号),在这种条件下平衡常数K值不变
不变
(填“增大”、“变小”或“不变’,).A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
37%
37%
.