题目内容
在真空密闭容器中加入 a mol PH4I固体,在一定温度下发生反应:
PH4I(s) PH3(g )+HI(g),4PH3(g)
PH3(g )+HI(g),4PH3(g) P4(g )+6H2(g),
P4(g )+6H2(g),
2HI(g) H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
求:①平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n (P4)=
6 mol
6 mol,n (PH3)=
mol
mol.
②a、b、c 三者的关系服从 a>
PH4I(s)
 PH3(g )+HI(g),4PH3(g)
PH3(g )+HI(g),4PH3(g) P4(g )+6H2(g),
P4(g )+6H2(g),2HI(g)
 H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.求:①平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n (P4)=
| (d-c) |
| 6 |
| (d-c) |
| 6 |
| (3b+8c-2d) |
| 3 |
| (3b+8c-2d) |
| 3 |
②a、b、c 三者的关系服从 a>
b+2c
b+2c
(填b、c的代数式).分析:①同时存在三个平衡,H2来自HI和PH3的分解,根据I2为c mol可知,HI分解产生的H2也为c mol,求出PH3分解产生的H2的物质的量,进而根据4PH3(g) P4(g )+6H2(g)求出n (P4);
P4(g )+6H2(g)求出n (P4);
求平衡时PH3的物质的量,则需要求出已分解的PH3,还有PH4I分解出的HI,PH4I分解出的HI为平衡与已分解的之和,即为PH4I分解出的PH3物质的量,根据PH3分解产生的H2的物质的量,求出已分解的PH3,进而求平衡时n (PH3);
②利用反应可逆,反应物不会完全分解的原则来确定大于关系.
 P4(g )+6H2(g)求出n (P4);
P4(g )+6H2(g)求出n (P4);求平衡时PH3的物质的量,则需要求出已分解的PH3,还有PH4I分解出的HI,PH4I分解出的HI为平衡与已分解的之和,即为PH4I分解出的PH3物质的量,根据PH3分解产生的H2的物质的量,求出已分解的PH3,进而求平衡时n (PH3);
②利用反应可逆,反应物不会完全分解的原则来确定大于关系.
解答:解:①d mol H2包含HI分解的和PH3分解的,
根据I2为c mol,结合2HI(g) H2(g )+I2 (g)可知,HI分解产生的H2也为c mol
H2(g )+I2 (g)可知,HI分解产生的H2也为c mol
所以PH3分解产生的H2为(d-c) mol,
根据4PH3(g) P4(g )+6H2(g)可知,P4物质的量n (P4)=
P4(g )+6H2(g)可知,P4物质的量n (P4)=
mol,
分解的PH3为
×4mol=
mol,
PH4I分解出的HI为平衡时的与已分解的之和,即为(b+2c)mol,这个也就是PH4I分解出的PH3物质的量,
所以平衡时PH3物质的量n (PH3)=(b+2c)mol-
mol=
mol,
故答案为:
mol;
mol;
②由①可知发生分解的PH4I的物质的量为(b+2c)mol,由于反应可逆,反应物不会完全分解,所以a>b+2c
故答案为:b+2c.
根据I2为c mol,结合2HI(g)
 H2(g )+I2 (g)可知,HI分解产生的H2也为c mol
H2(g )+I2 (g)可知,HI分解产生的H2也为c mol所以PH3分解产生的H2为(d-c) mol,
根据4PH3(g)
 P4(g )+6H2(g)可知,P4物质的量n (P4)=
P4(g )+6H2(g)可知,P4物质的量n (P4)=| (d-c) |
| 6 |
分解的PH3为
| (d-c) |
| 6 |
| 2(d-c) |
| 3 |
PH4I分解出的HI为平衡时的与已分解的之和,即为(b+2c)mol,这个也就是PH4I分解出的PH3物质的量,
所以平衡时PH3物质的量n (PH3)=(b+2c)mol-
| 2(d-c) |
| 3 |
| (3b+8c-2d) |
| 3 |
故答案为:
| (d-c) |
| 6 |
| (3b+8c-2d) |
| 3 |
②由①可知发生分解的PH4I的物质的量为(b+2c)mol,由于反应可逆,反应物不会完全分解,所以a>b+2c
故答案为:b+2c.
点评:本题考查化学平衡的计算,注意利用反应的可逆性,反应物不会完全分解的原则来确定关系即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


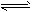 PH3(g)+HI(g)
PH3(g)+HI(g)  P4(S)+6H2(g)
P4(S)+6H2(g) 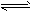 H2(g)+I2(g)
H2(g)+I2(g)  PH3(g )+HI(g),4PH3(g)
PH3(g )+HI(g),4PH3(g) P4(g )+6H2(g),
P4(g )+6H2(g), H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.
H2(g )+I2 (g) 以上三个反应建立平衡后,测得HI为b mol,I2 (g)为c mol,H2 为d mol.