网址:http://m.1010jiajiao.com/timu3_id_180973[举报]
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: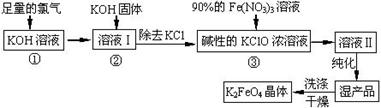
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(7)如何判断K2FeO4晶体已经洗涤干净 。 查看习题详情和答案>>
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
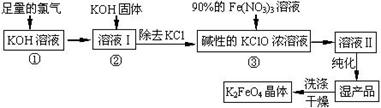
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(7)如何判断K2FeO4晶体已经洗涤干净 。
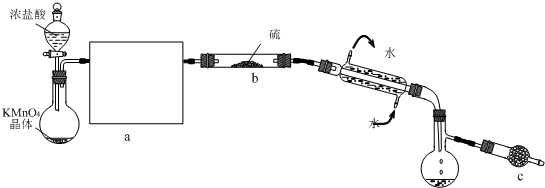
请回答下列问题:
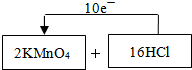
(1)制取氯气的化学反应方程式(未配平)为:KMnO4+HCl(浓)-MnCl2+KCl+Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列空格中,并标出电子转移的方向和数目:

(2)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是
(3)①在方框a中画出所缺装置图,并注明相关试剂的名称.
②图中c装置中应放置的试剂为碱石灰,其作用为
(4)某同学通过查阅资料发现:实验室常利用软锰矿(主要成分为MnO2和一些不溶性杂质)制取KMnO4晶体,其反应原理如下:
3MnO2+6KOH+KClO3
| ||
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
请设计由软锰矿制备KMnO4晶体的实验步骤:①
(1)已知下列反应中,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
□I2+□KClO3+□H2O→□KH(IO3)2+□KCl+□Cl2↑。
(2)在生成碘酸氢钾时用稀酸酸化时不能用盐酸,因为盐酸会与碘酸氢钾反应而生成氯气、碘单质及氯化钾,请写出反应的化学方程式 。
(3)如果在得到碘酸氢钾后省略了“加热使所有的氯气都逸出。冷却结晶后可得到碘酸氢钾晶体,再溶解于水得到碘酸氢钾溶液。”直接用KOH溶液调节pH,则可能会导致碘酸钾的产率 ;原因是 。
(4)用题给的方法生产碘酸钾时,得到的碘酸钾23.54g与KClO溶液混合反应后得到的高碘酸钾为23g,试写出反应的离子方程式 ,则该碘酸钾的纯度为
(分)加碘盐可防止碘缺乏病,目前加碘盐中加入的是碘酸钾。碘酸钾晶体通常情况下有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。工业上制碘酸钾的方法是:将碘单质与氯酸钾混合后加入稀酸酸化加热可反应生成碘酸氢钾及氯化钾、氯气。加热使所有的氯气都逸出。冷却结晶后可得到碘酸氢钾晶体,再溶解于水得到碘酸氢钾溶液。用KOH溶液调节pH值,再蒸发结晶即可得到碘酸钾。
(1)已知下列反应中,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
□I2+□KClO3+□H2O→□KH(IO3)2+□KCl+□Cl2↑。
(2)在生成碘酸氢钾时用稀酸酸化时不能用盐酸,因为盐酸会与碘酸氢钾反应而生成氯气、碘单质及氯化钾,请写出反应的化学方程式 。
(3)如果在得到碘酸氢钾后省略了“加热使所有的氯气都逸出。冷却结晶后可得到碘酸氢钾晶体,再溶解于水得到碘酸氢钾溶液。”直接用KOH溶液调节pH,则可能会导致碘酸钾的产率 ;原因是 。
(4)用题给的方法生产碘酸钾时,得到的碘酸钾23.54g与KClO溶液混合反应后得到的高碘酸钾为23g,试写出反应的离子方程式 ,则该碘酸钾的纯度为
查看习题详情和答案>>