题目内容
(2011?泰州二模)S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),易水解,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质.向熔融的硫中通以干燥、纯净的Cl2即可生成S2Cl2.下图是实验室制备S2Cl2的装置(夹持装置、加热装置均已略去).
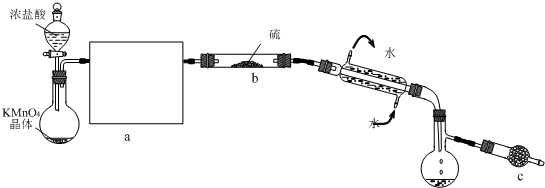
请回答下列问题:
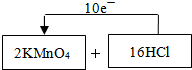
(1)制取氯气的化学反应方程式(未配平)为:KMnO4+HCl(浓)-MnCl2+KCl+Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列空格中,并标出电子转移的方向和数目:

(2)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是
(3)①在方框a中画出所缺装置图,并注明相关试剂的名称.
②图中c装置中应放置的试剂为碱石灰,其作用为
(4)某同学通过查阅资料发现:实验室常利用软锰矿(主要成分为MnO2和一些不溶性杂质)制取KMnO4晶体,其反应原理如下:
3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
请设计由软锰矿制备KMnO4晶体的实验步骤:①

请回答下列问题:
(1)制取氯气的化学反应方程式(未配平)为:KMnO4+HCl(浓)-MnCl2+KCl+Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列空格中,并标出电子转移的方向和数目:


(2)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是
将玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
将玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
.(3)①在方框a中画出所缺装置图,并注明相关试剂的名称.
②图中c装置中应放置的试剂为碱石灰,其作用为
吸收尾气中的氯气,同时防止空气中的水进入使S2Cl2发生水解
吸收尾气中的氯气,同时防止空气中的水进入使S2Cl2发生水解
.(4)某同学通过查阅资料发现:实验室常利用软锰矿(主要成分为MnO2和一些不溶性杂质)制取KMnO4晶体,其反应原理如下:
3MnO2+6KOH+KClO3
| ||
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
请设计由软锰矿制备KMnO4晶体的实验步骤:①
将软锰矿与固体KOH和KClO3在高温下共熔,发生反应
将软锰矿与固体KOH和KClO3在高温下共熔,发生反应
;②冷却,加水溶解,滤去残渣
冷却,加水溶解,滤去残渣
;③将滤液酸化,滤去MnO2沉淀
将滤液酸化,滤去MnO2沉淀
;④加热浓缩,冷却结晶
加热浓缩,冷却结晶
.分析:(1)根据化合价的变化判断电子转移的方向和数目;
(2)实验中为保证分液漏斗中液体正常流下,应打开活塞,并将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
(3)①制备氯气中含有氯化氢和水蒸气,应分别通入饱和食盐水和浓硫酸的洗气瓶除去;
②S2Cl2是一种易水解的物质,碱石灰具有吸水作用并能与氯气反应,起到尾气吸收作用;
(4)由软锰矿制备KMnO4晶体的化学反应以及物质的性质确定操作步骤为:高温共熔→冷却、溶解、过滤→酸化、过滤→加热浓缩、冷却结晶;
(2)实验中为保证分液漏斗中液体正常流下,应打开活塞,并将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
(3)①制备氯气中含有氯化氢和水蒸气,应分别通入饱和食盐水和浓硫酸的洗气瓶除去;
②S2Cl2是一种易水解的物质,碱石灰具有吸水作用并能与氯气反应,起到尾气吸收作用;
(4)由软锰矿制备KMnO4晶体的化学反应以及物质的性质确定操作步骤为:高温共熔→冷却、溶解、过滤→酸化、过滤→加热浓缩、冷却结晶;
解答:解:(1)反应中KMnO4→MnCl2,Mn元素的化合价降低,由+7价降到+2价,KMnO4反应中得电子;HCl→Cl2,Cl元素化合价升高,由-1价升高到0价,HCl反应中失去电子,根据电子得失总数相等可标出电子转移的方向和数目,可为 ,
,
故答案为:
(2)实验中为保证分液漏斗中液体正常流下,应打开活塞,并将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
故答案为:将玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
(3)①制备氯气中含有氯化氢和水蒸气,应分别通入饱和食盐水和浓硫酸的洗气瓶除去,装置图为 ,
,
故答案为: ;
;
②S2Cl2是一种易水解的物质,碱石灰具有吸水作用,能与水反应生成氢氧化钙,并且生成的S2Cl2中含有氯气,不能排放到空气中,碱石灰也可起到吸收氯气的作用,
故答案为:吸收尾气中的氯气,同时防止空气中的水进入使S2Cl2发生水解;
(4)根据题中信息可知,将软锰矿与固体KOH和KClO3在高温下共熔,发生反应生成锰酸钾和氯化钾,冷却、加水溶解后可得到锰酸钾,在酸性条件下锰酸钾自身发生氧化还原反应生成高锰酸钾和二氧化锰,过滤除去二氧化锰,再经过加热浓缩,冷却结晶可得高锰酸钾固体.
故答案为:将软锰矿与固体KOH和KClO3在高温下共熔,发生反应;冷却,加水溶解,滤去残渣;将滤液酸化,滤去MnO2沉淀;加热浓缩,冷却结晶;
 ,
,故答案为:

(2)实验中为保证分液漏斗中液体正常流下,应打开活塞,并将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
故答案为:将玻璃塞上的凹槽与漏斗口颈上的小孔对准(或拔去玻璃塞);
(3)①制备氯气中含有氯化氢和水蒸气,应分别通入饱和食盐水和浓硫酸的洗气瓶除去,装置图为
 ,
,故答案为:
 ;
;②S2Cl2是一种易水解的物质,碱石灰具有吸水作用,能与水反应生成氢氧化钙,并且生成的S2Cl2中含有氯气,不能排放到空气中,碱石灰也可起到吸收氯气的作用,
故答案为:吸收尾气中的氯气,同时防止空气中的水进入使S2Cl2发生水解;
(4)根据题中信息可知,将软锰矿与固体KOH和KClO3在高温下共熔,发生反应生成锰酸钾和氯化钾,冷却、加水溶解后可得到锰酸钾,在酸性条件下锰酸钾自身发生氧化还原反应生成高锰酸钾和二氧化锰,过滤除去二氧化锰,再经过加热浓缩,冷却结晶可得高锰酸钾固体.
故答案为:将软锰矿与固体KOH和KClO3在高温下共熔,发生反应;冷却,加水溶解,滤去残渣;将滤液酸化,滤去MnO2沉淀;加热浓缩,冷却结晶;
点评:本题考查物质的制备实验,涉及氧化还原反应、物质的分离和提纯、实验基本操作以及物质的制备,本题具有一定难度,注意对基础知识的理解和应用.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
 (2011?泰州二模)下列有关溶液中粒子浓度的关系式中,正确的是( )
(2011?泰州二模)下列有关溶液中粒子浓度的关系式中,正确的是( )