摘要:25.标准状况下,由干燥的NO2.NH3和H2三种气体组成的混合气体11.2L,将它通过稀硫酸后,发现溶液质量增加了12.5g,气体体积缩小到4.48L.求混和气体中各气体的体积分别是多少升?. 高一年级化学第一学期期末考试
网址:http://m.1010jiajiao.com/timu3_id_177431[举报]
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用.

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加
Na2SiO3溶液与过量的CO2反应的离子方程式为
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
①实验①最先溶解的金属发生反应的化学方程式是
②滤渣B中Fe的质量分数为
查看习题详情和答案>>

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和
Cu
Cu
(填化学式).(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为
H2O2(或O2)
H2O2(或O2)
;滤渣D、稀硫酸和试剂a总反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
.(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加
过量盐酸,先有白色沉淀生成,继续滴加盐酸,白色沉淀全部溶解证明不不含硅酸钠
过量盐酸,先有白色沉淀生成,继续滴加盐酸,白色沉淀全部溶解证明不不含硅酸钠
.Na2SiO3溶液与过量的CO2反应的离子方程式为
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
.(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,体积) | 1.12 | 2.24 | 3.36 | 4.48 |
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
.②滤渣B中Fe的质量分数为
63.6%
63.6%
%(精确到0.1%).
为了确定一批合金废料的成分并加以回收利用,某同学拟定了如图实验方案:
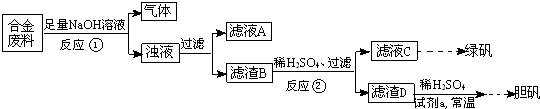
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe 和 (填化学式).
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为 ;滤渣D、稀硫酸和试剂a总反应的化学方程式为 .
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na4SiO4(H4SiO4白色胶状沉淀)的方法是:取少量滤液A于试管中,滴加 .
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的
NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
①实验①最先溶解的金属是 ;
②实验④中金属全部溶解后,再发生的反应是Fe2+和HNO3,则滤渣B中Fe的质量分数为 %(精确到0.1%).
查看习题详情和答案>>

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe 和
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na4SiO4(H4SiO4白色胶状沉淀)的方法是:取少量滤液A于试管中,滴加
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的
NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②实验④中金属全部溶解后,再发生的反应是Fe2+和HNO3,则滤渣B中Fe的质量分数为
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
|
实验编号 |
① |
② |
③ |
④ |
|
稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
|
剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
|
NO体积(L,标况) |
1.12 |
2.24 |
3.36 |
4.48 |
①实验①最先溶解的金属发生反应的化学方程式是 。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
查看习题详情和答案>>