题目内容
将质量为m g的铁粉与铜粉的混合物,溶于足量的稀HNO3溶液,充分反应后得到标准状况下1.12L的NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为( )A.(m+25.5)g
B.(m+1.7)g
C.(m+3.4)g
D.(m+2.55)g
【答案】分析:加入足量的NaOH溶液得到沉淀为氢氧化铁、氢氧化铜,根据电荷守恒可知,沉淀中氢氧根的物质的量等于金属提供的电子的物质的量,根据生成的NO利用电子转移守恒计算金属提供的电子的物质的量,沉淀质量等于金属质量与氢氧根质量之和.
解答:解:加入足量的NaOH溶液得到沉淀为氢氧化铁、氢氧化铜,根据电荷守恒可知,沉淀中氢氧根的物质的量等于金属提供的电子的物质的量.标准状况下1.12LNO的物质的量为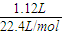 =0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.
=0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.
故选:D.
点评:考查氧化还原反应的计算等,难度中等,判断沉淀中氢氧根的物质的量等于金属提供的电子的物质的量是解题关键.
解答:解:加入足量的NaOH溶液得到沉淀为氢氧化铁、氢氧化铜,根据电荷守恒可知,沉淀中氢氧根的物质的量等于金属提供的电子的物质的量.标准状况下1.12LNO的物质的量为
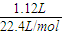 =0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.
=0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.故选:D.
点评:考查氧化还原反应的计算等,难度中等,判断沉淀中氢氧根的物质的量等于金属提供的电子的物质的量是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目