��Ŀ����
ijͬѧ�ⶨ������ʵ�鷽������ȷ��һ���Ͻ���ϵijɷֲ����Ի������á�

��ش��������⣺
��1����������Ϣ��ȷ���úϽ���һ������Fe��____���ѧʽ����
��2�����Լ�a����һ�ֲ��������ʵ���ɫ�����������������Ļ�ѧʽΪ____������D��ϡ������Լ�a�ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��3������Ӧ�ٲ�����������H2������֤��ҺAֻ��NaAlO2������Na2SiO3�ķ����ǣ�ȡ������ҺA���Թ��У��μ� ��
Na2SiO3��Һ�������CO2��Ӧ�����ӷ���ʽΪ ��
��4��ȡ������Ϊ13��2g������B�ķݣ��ֱ������ͬŨ�ȣ���ͬ�����ϡHNO3��ַ�Ӧ����״���������ɵ�NO���軹ԭ����ֻ��һ�֣������ʣ�����������������±���
|
ʵ���� |
�� |
�� |
�� |
�� |
|
ϡHNO3���(mL) |
100 |
200 |
300 |
400 |
|
ʣ���������(g) |
9��0 |
4��8 |
0 |
0 |
|
NO���(L,���) |
1��12 |
2��24 |
3��36 |
4��48 |
��ʵ��������ܽ�Ľ���������Ӧ�Ļ�ѧ����ʽ�� ��
������B��Fe����������Ϊ____%����ȷ��0��1%����
(1)Cu��1�֣�(2)H2O2(��O3)��1�֣�Cu+H2O2+H2SO4��CuSO4+2H2O
��2�֣�(3) ��εμ�ϡ����(��ϡ����)��������1�֣��������а�ɫ������1�֣���Ȼ�������ȫ�ܽ⣨1�֣�SiO32-+2CO2+2H2O��H2SiO3��+2HCO3-��2�֣�
��4����3Fe+8HNO3��3Fe(NO3)3+2NO��+4H2O��2�֣���63.6%��2�֣�
��������
�����������1����ϲ����ж�����������������˵��B�к���ͭ�����úϽ���һ������Fe��Cu��
��2��˫��ˮ�����������һ�ֳ�������ɫ����������˫��ˮ�������£�����ͭ�������б�������������ͭ��������Ӧ�Ļ�ѧ����ʽΪCu+H2O2+H2SO4��CuSO4+2H2O��Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O��
��3������ƫ������������ƾ����ᷴӦ���ɰ�ɫ��������ƫ���������ɵ���������������������������ܽ������С������������ɵĹ�����ܽ������У��ݴ˿��Լ�����ߡ�����֤��ҺAֻ��NaAlO2������Na2SiO3�ķ�����ȡ������ҺA���Թ��У��μ����ᣬ��ʼ���ɰ�ɫ����Ϊ���������������μ����ᣬ�����������ܽ������Ȼ������ް�ɫ��������֤�����������ƣ�̼�����Դ��ڹ��ᣬ��˹���������̼ͨ���������Һ�У���Ӧ���ɹ��������̼�����ƣ���Ӧ�����ӷ���ʽΪ��SiO32-+2CO2+2H2O��H2SiO3��+2HCO3-��
��4�����������Ļ�ԭ�Դ���ͭ�����������������ᷢ��������ԭ��Ӧ�����ʵ����з�����Ӧ�Ļ�ѧ����ʽΪ3Fe+8HNO3��3Fe(NO3)3+2NO��+4H2O��
���ɢ١����������ݷ���������ʵ���н�������������㡣�����ܽ������������13.2g��9.0g��4.2g����ʱ����1.12LNO���壬���ʵ�����1.12L��22.4L/mol��0.05mol��ת��0.05mol��3��0.15 mol���ӣ������ڽ�����ʣ�࣬�����ɵ�Ӧ�����������ӡ���ֻ�ܽ��������������ʵ�����0.15mol��2��0.075mol������Ϊ0.075mol��56g/mol��4.2gg����ֻ�ܽ�ͭ��ͭ�����ʵ�����0.15mol��2��0.075mol������Ϊ0.075mol��64g/mol��4.8g���ɴ˿�֪��ʵ�����ǡ���ܽ���4.2g������������ʵ��ڿ�֪���ڱȢ��ֶ��ܽ���9.0g��4.8g��4.2g���������ڱȢٶ�������2.24L��1.21L��1.12LNO���壬��˵��ʵ����й�ǡ���ܽ���8.4g�������������ݢ۱Ȣڶ�������3.36L��2.24L��1.12LNO�����֪��ʣ���4.8g����ȫ����Cu��ʵ��ܱȢ��ֶ�������1.12LNO���������ڷ����˷�Ӧ3Fe2++NO3-+4H+��3Fe3++NO��+2H2O���ɴ˿�֪�������������������� ��100%��63.6%��
��100%��63.6%��
���㣺�������ʶ����ⶨ��ʵ�鷽��Ӧ���Լ�������ԭ��Ӧ���й��жϺͼ���

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�ijͬѧ�ⶨ������ʵ�鷽������ȷ��һ���Ͻ���ϵijɷֲ����Ի������ã�
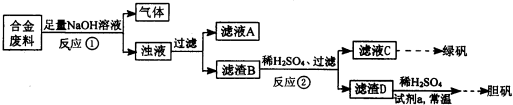
��ش��������⣺
��1����������Ϣ��ȷ���úϽ���һ������Fe��______���ѧʽ����
��2�����Լ�a����һ�ֲ��������ʵ���ɫ�����������������Ļ�ѧʽΪ______������D��ϡ������Լ�a�ܷ�Ӧ�Ļ�ѧ����ʽΪ______��
��3������Ӧ�ٲ�����������H2������֤��ҺAֻ��NaAlO2������Na2SiO3�ķ����ǣ�ȡ������ҺA���Թ��У��μ�______��
Na2SiO3��Һ�������CO2��Ӧ�����ӷ���ʽΪ______��
��4��ȡ������Ϊ13.2g������B�ķݣ��ֱ������ͬŨ�ȣ���ͬ�����ϡHNO3��ַ�Ӧ����״���������ɵ�NO���軹ԭ����ֻ��һ�֣������ʣ�����������������±���
| ʵ���� | �� | �� | �� | �� |
| ϡHNO3�����mL�� | 100 | 200 | 300 | 400 |
| ʣ�����������g�� | 9.0 | 4.8 | 0 | 0 |
| NO�����L������� | 1.12 | 2.24 | 3.36 | 4.48 |
������B��Fe����������Ϊ______%����ȷ��0.1%����

��ش��������⣺
��1����������Ϣ��ȷ���úϽ���һ������Fe��______���ѧʽ����
��2�����Լ�a����һ�ֲ��������ʵ���ɫ�����������������Ļ�ѧʽΪ______������D��ϡ������Լ�a�ܷ�Ӧ�Ļ�ѧ����ʽΪ______��
��3������Ӧ�ٲ�����������H2������֤��ҺAֻ��NaAlO2������Na2SiO3�ķ����ǣ�ȡ������ҺA���Թ��У��μ�______��
Na2SiO3��Һ�������CO2��Ӧ�����ӷ���ʽΪ______��
��4��ȡ������Ϊ13.2g������B�ķݣ��ֱ������ͬŨ�ȣ���ͬ�����ϡHNO3��ַ�Ӧ����״���������ɵ�NO���軹ԭ����ֻ��һ�֣������ʣ�����������������±���
| ʵ���� | �� | �� | �� | �� |
| ϡHNO3�����mL�� | 100 | 200 | 300 | 400 |
| ʣ�����������g�� | 9.0 | 4.8 | ||
| NO�����L������� | 1.12 | 2.24 | 3.36 | 4.48 |
������B��Fe����������Ϊ______%����ȷ��0.1%����
