摘要:19.试分析3NO2 + H2O = 2HNO3 + NO反应中化合价变化的关系.标出电子转移的方向与数目.指出 是氧化剂. 是还原剂.氧化剂与还原剂的质量比是 .
网址:http://m.1010jiajiao.com/timu3_id_172526[举报]
合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g) 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)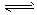 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
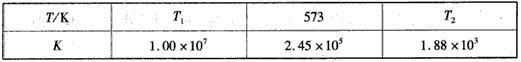
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
 2NH3(g)
2NH3(g) △H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)
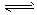 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。 ①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
(3)673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。
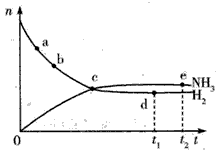
A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
查看习题详情和答案>>
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:(1)该废液中可能大量存在的一种阴离子是
D
D
(选填序号)?A.SO42- B.CO32- C.Cl- D.NO3-
(2)经检测废液中铝元素的含量较高,需将其与其他三种离子分开,请选用合适的试剂,写出铝元素与该试剂反应时的离子方程式:
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.(3)为了回收废液中的金属银,某同学设计了如图所示的方案.若依该方案获得金属银10.80g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2体积为
1.12
1.12
L.下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,
水只作氧化剂的反应是
水只作还原剂的反应是
水既作氧化剂,又作还原剂是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
查看习题详情和答案>>
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号).(2)在这些氧化还原反应中,
水只作氧化剂的反应是
①④
①④
(填编号);水只作还原剂的反应是
⑥
⑥
(填编号);水既作氧化剂,又作还原剂是
⑤
⑤
(填编号);水既不作氧化剂,又不作还原剂是
②
②
(填编号).(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是3NO2
3NO2
,还原剂是3NO2
3NO2
.A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生如图所示的物质之间的一系列变化:

若E为黄绿色气体,F为无色刺激性气味的气体,H不溶于稀硝酸.请填写下列空白.
(1)气体F的化学式为
(2)写出下列反应的离子方程式:C→E
(3)试分析E和F按下列两种情况分别通入水中,所得溶液分别滴入几滴石蕊溶液的现象:
①E和F物质的量相等,现象为:
②E和F物质的量不等,且E大于F,现象为:
(4)向C的溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-)/c(Cl-)=
[已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10].
查看习题详情和答案>>

若E为黄绿色气体,F为无色刺激性气味的气体,H不溶于稀硝酸.请填写下列空白.
(1)气体F的化学式为
SO2
SO2
,B中溶质的化学式为Na2SO3
Na2SO3
.(2)写出下列反应的离子方程式:C→E
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
;D+G→H
| ||
BaSO3+2H++SO42-=BaSO4↓+SO2↑+H2O
BaSO3+2H++SO42-=BaSO4↓+SO2↑+H2O
;(3)试分析E和F按下列两种情况分别通入水中,所得溶液分别滴入几滴石蕊溶液的现象:
①E和F物质的量相等,现象为:
变红色
变红色
;原因为(用化学方程式表示)Cl2+SO2+2H2O=H2SO4+2HCl
Cl2+SO2+2H2O=H2SO4+2HCl
.②E和F物质的量不等,且E大于F,现象为:
先变红后褪色(或褪色)
先变红后褪色(或褪色)
;原因为(文字说明)变红是因为溶液呈酸性,褪色是因为氯气过量生成次氯酸使溶液褪色
变红是因为溶液呈酸性,褪色是因为氯气过量生成次氯酸使溶液褪色
.(4)向C的溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-)/c(Cl-)=
2.7×10-3
2.7×10-3
.[已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10].
在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是
A.SO42- B.NO3-C.Cl- D.CO32-
(2)为检测废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂是
(3)为了回收废液中的金属银,某同学设计了如图所示方案:
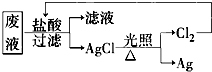
若依该方案获得108g Ag,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下H2的体积是
查看习题详情和答案>>
(1)该废液中可能大量存在的一种阴离子是
B
B
(填序号)A.SO42- B.NO3-C.Cl- D.CO32-
(2)为检测废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂是
NaOH溶液
NaOH溶液
;铝元素发生变化的离子方程式是Al3++4OH-═AlO2-+2H2O
Al3++4OH-═AlO2-+2H2O
;(3)为了回收废液中的金属银,某同学设计了如图所示方案:

若依该方案获得108g Ag,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下H2的体积是
11.2L
11.2L
.