网址:http://m.1010jiajiao.com/timu3_id_169467[举报]
| A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定 |
| B.手性催化剂只催化或者主要催化一种手性分子的合成 |
| C.用金属的电子气理论能合理地解释金属易腐蚀的原因 |
| D.H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位键 |
(1)基态碳原子的价电子排布图可表示为________。
(2)第一电离能:碳原子________(填“>”“<”或“=”)氧原子,原因是__________________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
(1)上述四种酸中,酸性最弱的是
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v (N2)正=3v (H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正
I下列实验设计、操作或实验现象合理的是_________(填序号)
A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
 II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有过量乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
(1)A中浓硫酸的作用是
反应中加入的乙醇是过量的,其目的是________________________________。
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式 ;
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是_______________________ 。
(4)反应结束后D中的现象是 。
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰
查看习题详情和答案>>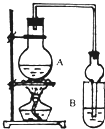 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰. 查看习题详情和答案>>
(1)判断反应达到平衡状态的依据是
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为
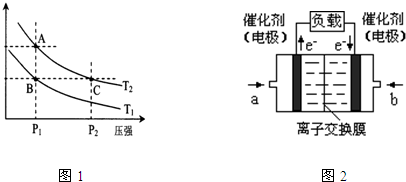
(3)图1表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量.写出该反应的热化学方程式