题目内容
Ⅰ.下列有关说法正确的是________。
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为________。
(2)第一电离能:碳原子________(填“>”“<”或“=”)氧原子,原因是__________________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
| A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定 |
| B.手性催化剂只催化或者主要催化一种手性分子的合成 |
| C.用金属的电子气理论能合理地解释金属易腐蚀的原因 |
| D.H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位键 |
(1)基态碳原子的价电子排布图可表示为________。
(2)第一电离能:碳原子________(填“>”“<”或“=”)氧原子,原因是__________________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
Ⅰ.ABD
Ⅱ.(1)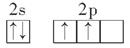
(2)< 碳原子的半径比氧原子大,且核电荷数比氧的小,故碳原子核对最外层电子的吸引力小于氧
(3)8 每个水分子与相邻的4个水分子形成氢键
(4)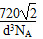
(5)CH2=CH2+Br2―→BrCH2CH2Br
Ⅱ.(1)

(2)< 碳原子的半径比氧原子大,且核电荷数比氧的小,故碳原子核对最外层电子的吸引力小于氧
(3)8 每个水分子与相邻的4个水分子形成氢键
(4)
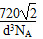
(5)CH2=CH2+Br2―→BrCH2CH2Br
Ⅰ.C项,用金属的电子气理论只能解释金属的物理性质,不能解释金属易腐蚀;D项,H3O+中H和O,NH4Cl中N和H、[Ag(NH3)2]+中Ag和N存在配位键。
Ⅱ.(3)金刚石的晶胞中8个C在顶点,6个碳在面心,4个C在内部,则每个冰晶胞平均占有水分子个数为8×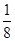 +6×
+6× +4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8×
+4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8×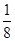 +6×
+6× =4,设晶胞的边长为a,则
=4,设晶胞的边长为a,则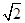 a=2d,a=
a=2d,a=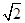 d,故晶体的密度为
d,故晶体的密度为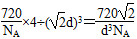 。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。
。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。
点拨:本题考查物质结构和性质,考查考生对原子、分子、晶体结构和性质的理解能力。难度较大。
Ⅱ.(3)金刚石的晶胞中8个C在顶点,6个碳在面心,4个C在内部,则每个冰晶胞平均占有水分子个数为8×
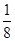 +6×
+6× +4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8×
+4=8。(4)C60的晶体为面心立方堆积,则含C60的个数为8×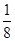 +6×
+6× =4,设晶胞的边长为a,则
=4,设晶胞的边长为a,则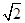 a=2d,a=
a=2d,a=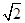 d,故晶体的密度为
d,故晶体的密度为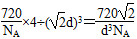 。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。
。(5)sp2杂化的碳为形成双键碳原子,sp3杂化的碳为形成单键碳原子,可以是乙烯与Br2、H2、HX、H2O等的加成反应。点拨:本题考查物质结构和性质,考查考生对原子、分子、晶体结构和性质的理解能力。难度较大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)

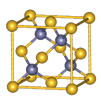
 的空间构型为 ,与其互为等电子体的一种分子为 。
的空间构型为 ,与其互为等电子体的一种分子为 。 