题目内容
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
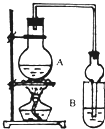
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.
分析:I.A.纤维素水解是在酸性环境下,而醛与新制氢氧化铜反应是在碱性条件下发生;
B.溴乙烷水解在碱性环境下产生溴离子,加入足量的硝酸中和氢氧化钠,再加入AgNO3溶液根据产生溴化银沉淀就可以检验Br-的生成;
C.甲酸和甲醛都含有醛基都可以发生银镜反应;
D.苯酚与浓溴水反应生成的2,4.6-三溴苯酚弄溶解在苯中;
E.铜丝在酒精度上灼烧反应生成黑色的氧化铜,插入乙醇后将乙醇氧化为乙醛,本身被还原为铜;
F.萃取剂选择的原则:①和原溶液中的溶剂互不相溶②对溶质的溶解度要远大于原溶剂③萃取剂不能与原溶液的溶剂反应;
G.醛与新制氢氧化铜的反应是在碱性条件下发生.
Ⅱ.(1)在浓硫酸作催化剂、加热的条件下乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水使平衡向生成乙酸乙酯方向移动,乙醇沸点低,易挥发,增加乙醇的用量可以促进反应向正方向进行;
(2)酯化反应的原理是酸去羟基醇去氢;
(3)混合气体中含有乙醇乙酸蒸汽,易溶于水容易发生倒吸;
(4)乙酸乙酯难溶于水,密度小于水,溶液分层,上层有机层;
(5)根据题给信息“①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH”说明加入无水氯化钙可除去乙醇,
蒸馏中加入的成分,既要考虑吸收水,又要与乙酸乙酯不反应.
B.溴乙烷水解在碱性环境下产生溴离子,加入足量的硝酸中和氢氧化钠,再加入AgNO3溶液根据产生溴化银沉淀就可以检验Br-的生成;
C.甲酸和甲醛都含有醛基都可以发生银镜反应;
D.苯酚与浓溴水反应生成的2,4.6-三溴苯酚弄溶解在苯中;
E.铜丝在酒精度上灼烧反应生成黑色的氧化铜,插入乙醇后将乙醇氧化为乙醛,本身被还原为铜;
F.萃取剂选择的原则:①和原溶液中的溶剂互不相溶②对溶质的溶解度要远大于原溶剂③萃取剂不能与原溶液的溶剂反应;
G.醛与新制氢氧化铜的反应是在碱性条件下发生.
Ⅱ.(1)在浓硫酸作催化剂、加热的条件下乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水使平衡向生成乙酸乙酯方向移动,乙醇沸点低,易挥发,增加乙醇的用量可以促进反应向正方向进行;
(2)酯化反应的原理是酸去羟基醇去氢;
(3)混合气体中含有乙醇乙酸蒸汽,易溶于水容易发生倒吸;
(4)乙酸乙酯难溶于水,密度小于水,溶液分层,上层有机层;
(5)根据题给信息“①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH”说明加入无水氯化钙可除去乙醇,
蒸馏中加入的成分,既要考虑吸收水,又要与乙酸乙酯不反应.
解答:解:I.A.醛与新制氢氧化铜反应是在碱性条件下发生,故A错误;
B.溴乙烷水解在碱性环境下产生溴离子,加入足量的硝酸中和氢氧化钠,再加入AgNO3溶液根据产生溴化银沉淀就可以检验Br-的生成,故B正确;
C.甲酸和甲醛都含有醛基都可以发生银镜反应,故C错误;
D.根据相似相溶原理苯酚与浓溴水反应生成的2,4.6-三溴苯酚弄溶解在苯中,不能将其分开,故D错误;
E.铜丝在酒精度上灼烧反应生成黑色的氧化铜,插入乙醇后将乙醇氧化为乙醛,本身被还原为铜,故E正确;
F.乙醇和水互溶不能做萃取剂,故F错误;
G.新制的氢氧化铜中氢氧化钠应该过量,醛与新制氢氧化铜的反应是在碱性条件下发生,故G错误;
故答案为:BE.
Ⅱ.(1)浓硫酸具有吸水性,是平衡向正方向移动,增大乙醇的用量可以使平衡向正方向移动,故答案为:
催化剂、吸水剂;促进反应平衡向正方向移动;
(2)乙醇与乙酸发生酯化反应的方程式:
CH3CH218OH+CH3COOH
CH3CH218OOCCH3+H2O或者CH3CH2OH+CH3CO18OH
CH3CH2OOCCH3+H218O,
故答案为:CH3CH218OH+CH3COOH
CH3CH218OOCCH3+H2O或者CH3CH2OH+CH3CO18OH
CH3CH2OOCCH3+H218O;
(3)混合气体中含有乙醇乙酸蒸汽,易溶于水容易发生倒吸,球型干燥管可以防止倒吸,故答案为:防止倒吸;
(4)乙酸乙酯难溶于水,密度小于水,故答案为:溶液分层,上层为无色油状液态;
(5)根据题给信息“①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH”说明加入无水氯化钙可除去乙醇,
蒸馏中加入的成分,既要考虑吸收水,又要与乙酸乙酯不反应,故答案为:C.
B.溴乙烷水解在碱性环境下产生溴离子,加入足量的硝酸中和氢氧化钠,再加入AgNO3溶液根据产生溴化银沉淀就可以检验Br-的生成,故B正确;
C.甲酸和甲醛都含有醛基都可以发生银镜反应,故C错误;
D.根据相似相溶原理苯酚与浓溴水反应生成的2,4.6-三溴苯酚弄溶解在苯中,不能将其分开,故D错误;
E.铜丝在酒精度上灼烧反应生成黑色的氧化铜,插入乙醇后将乙醇氧化为乙醛,本身被还原为铜,故E正确;
F.乙醇和水互溶不能做萃取剂,故F错误;
G.新制的氢氧化铜中氢氧化钠应该过量,醛与新制氢氧化铜的反应是在碱性条件下发生,故G错误;
故答案为:BE.
Ⅱ.(1)浓硫酸具有吸水性,是平衡向正方向移动,增大乙醇的用量可以使平衡向正方向移动,故答案为:
催化剂、吸水剂;促进反应平衡向正方向移动;
(2)乙醇与乙酸发生酯化反应的方程式:
CH3CH218OH+CH3COOH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
故答案为:CH3CH218OH+CH3COOH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(3)混合气体中含有乙醇乙酸蒸汽,易溶于水容易发生倒吸,球型干燥管可以防止倒吸,故答案为:防止倒吸;
(4)乙酸乙酯难溶于水,密度小于水,故答案为:溶液分层,上层为无色油状液态;
(5)根据题给信息“①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH”说明加入无水氯化钙可除去乙醇,
蒸馏中加入的成分,既要考虑吸收水,又要与乙酸乙酯不反应,故答案为:C.
点评:本题考查了乙酸乙酯的制备实验,题目难度中等,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目