摘要:答第I卷前.考生务必将自己的姓名.考试号.考试科目.试卷类型用铅笔涂写在答题卡上,
网址:http://m.1010jiajiao.com/timu3_id_167630[举报]
一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究.请按要求完成下列研究报告.
【资料获悉】36.5%的浓盐酸的密度为1.19g?cm-3.
【探究思路】用1.00mol?L-1的稀盐酸测定样品溶液的组成.
【实验探究】用36.5%的浓盐酸配制1.00mol?L-1的稀盐酸需要的玻璃仪器有烧杯、容量瓶、量筒、
取20.0mL样品溶液不断加入1.00mol?L-1的稀盐酸,加入盐酸的体积和产生的现象见下表.
第I阶段溶液中反应的离子方程式为:
样品溶液中c(CO32-)=
【交流讨论】(1)如果将2.85g 某Na2CO3和NaHCO3的固体混合物溶于水制成溶液,然后逐滴加入1.00mol?L-1的稀盐酸并充分反应,若第Ⅰ阶段消耗盐酸的体积为15.0mL,当滴加到45.0mL时,反应的第Ⅱ阶段结束.则此Na2CO3和NaHCO3的混合物中Na2CO3的质量分数是多少?
(2)有同学认为,测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,完全不必将混合物配制成溶液,也不必要使用其他反应试剂,即可达到目的,则此时实验的主要操作方法的名称是称量和
查看习题详情和答案>>
【资料获悉】36.5%的浓盐酸的密度为1.19g?cm-3.
【探究思路】用1.00mol?L-1的稀盐酸测定样品溶液的组成.
【实验探究】用36.5%的浓盐酸配制1.00mol?L-1的稀盐酸需要的玻璃仪器有烧杯、容量瓶、量筒、
玻璃棒、胶头滴管
玻璃棒、胶头滴管
.取20.0mL样品溶液不断加入1.00mol?L-1的稀盐酸,加入盐酸的体积和产生的现象见下表.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
CO32-+H+=HCO3-
CO32-+H+=HCO3-
.样品溶液中c(CO32-)=
0.500mol?L-1
0.500mol?L-1
.【交流讨论】(1)如果将2.85g 某Na2CO3和NaHCO3的固体混合物溶于水制成溶液,然后逐滴加入1.00mol?L-1的稀盐酸并充分反应,若第Ⅰ阶段消耗盐酸的体积为15.0mL,当滴加到45.0mL时,反应的第Ⅱ阶段结束.则此Na2CO3和NaHCO3的混合物中Na2CO3的质量分数是多少?
(2)有同学认为,测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,完全不必将混合物配制成溶液,也不必要使用其他反应试剂,即可达到目的,则此时实验的主要操作方法的名称是称量和
加热
加热
,在实验中需要测定的数据有加热前、后固体的质量
加热前、后固体的质量
.工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法.
(一)工业实际吸收过程中,第I步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氧化后制得产品A.

(1)产品A是
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?
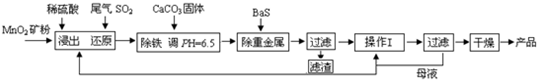
(二)制备MnSO4?H2O:SO2还原MnO2矿制备MnSO4?H2O,过程如下:

(1)生产中提高MnO2矿浸出率的措施除了将矿石粉碎还有
(2)除铁发生的离子反应方程式为
(3)操作I的名称为
(4)MnSO4?H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
查看习题详情和答案>>
(一)工业实际吸收过程中,第I步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氧化后制得产品A.

(1)产品A是
CaSO4
CaSO4
(填化学式).(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?
不可以
不可以
(填“可以”、“不可以”或“不确定”)原因是Ca(OH)2在水中溶解度较小,c(OH-)太低,吸收效率不高
Ca(OH)2在水中溶解度较小,c(OH-)太低,吸收效率不高
(二)制备MnSO4?H2O:SO2还原MnO2矿制备MnSO4?H2O,过程如下:

(1)生产中提高MnO2矿浸出率的措施除了将矿石粉碎还有
充分搅拌、适当提高体系温度等
充分搅拌、适当提高体系温度等
(答出一条即可).(2)除铁发生的离子反应方程式为
2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+ 或Fe3++3H2O  Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+ 或Fe3++3H2O  Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
. Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O(3)操作I的名称为
蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
.(4)MnSO4?H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
3MnSO4?H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O
 Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O3MnSO4?H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O
. Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法.
(一)工业实际吸收过程中,第I步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氧化后制得产品A.
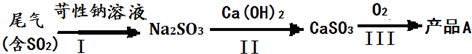
(1)产品A是______(填化学式).
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?______(填“可以”、“不可以”或“不确定”)原因是______
(二)制备MnSO4?H2O:SO2还原MnO2矿制备MnSO4?H2O,过程如下:
(1)生产中提高MnO2矿浸出率的措施除了将矿石粉碎还有______(答出一条即可).
(2)除铁发生的离子反应方程式为______.
(3)操作I的名称为______.
(4)MnSO4?H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是______.
查看习题详情和答案>>
工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法.
(一)工业实际吸收过程中,第I步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氧化后制得产品A.
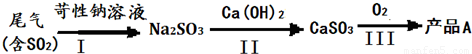
(1)产品A是______(填化学式).
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?______(填“可以”、“不可以”或“不确定”)原因是______
(二)制备MnSO4?H2O:SO2还原MnO2矿制备MnSO4?H2O,过程如下:
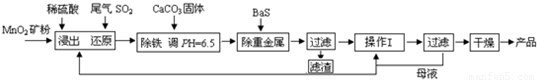
(1)生产中提高MnO2矿浸出率的措施除了将矿石粉碎还有______(答出一条即可).
(2)除铁发生的离子反应方程式为______.
(3)操作I的名称为______.
(4)MnSO4?H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是______.
查看习题详情和答案>>
(一)工业实际吸收过程中,第I步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氧化后制得产品A.
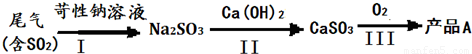
(1)产品A是______(填化学式).
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?______(填“可以”、“不可以”或“不确定”)原因是______
(二)制备MnSO4?H2O:SO2还原MnO2矿制备MnSO4?H2O,过程如下:

(1)生产中提高MnO2矿浸出率的措施除了将矿石粉碎还有______(答出一条即可).
(2)除铁发生的离子反应方程式为______.
(3)操作I的名称为______.
(4)MnSO4?H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是______.
查看习题详情和答案>>
近来,制备和利用氢气这一清洁能源已有多项成果.(1)德国克莱斯公司成功研制了利用甲醇CH3OH)车载制氢燃料电池工艺,其原理如图1所示,请观察此图回答: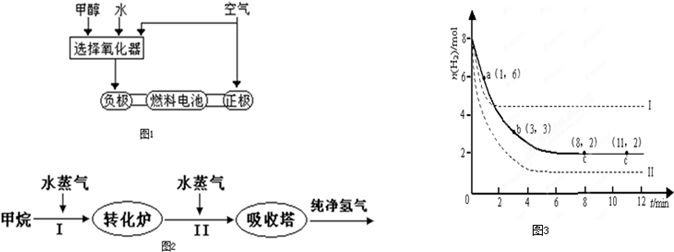
①此碱性燃料电池的正极反应式为
②甲醇与水反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
H2(g)+CO2(g),平衡常数随温度的变化如下表.
在830℃,n(CO)、n(H2O)、n(H2)、n(CO2)的物质的量分别是1、5、2、3投入恒容反应器发生上述反应,反应开始时,向
②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
②求平衡时氢气的转化率
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
查看习题详情和答案>>

①此碱性燃料电池的正极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②甲醇与水反应制取氢气的化学方程式
CH3OH+H2O?3H2+CO2
CH3OH+H2O?3H2+CO2
.(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
逆
逆
(填正、逆)反应方向进行.②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
.(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
大于
大于
(填大于、等于或小于)逆反应速率.②求平衡时氢气的转化率
75%
75%
和该条件下反应的平衡常数K=0.5
0.5
.③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
升高温度
升高温度
,曲线II对应的实验条件改变是增大压强
增大压强
.