网址:http://m.1010jiajiao.com/timu3_id_162795[举报]
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为
(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=
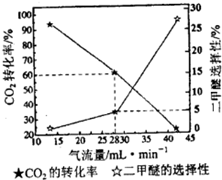
②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为
③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正
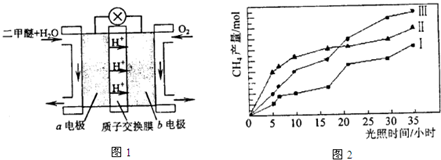
④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
(17分) 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l) ΔH=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
查看习题详情和答案>>
(10分)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:2CO(g)+O2(g)==2CO2(g) △H=-566KJ/mol
2H2(g)+O2(g)==2H2O(g) △H=-483.6KJ/mol H2O(g)="=" H2O(l) △H=-44.0KJ/mol
(1)1mol氢气燃烧生成液态水时放出的热为____________
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式_________________________。
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为___________;反应达到平衡后,升高温度,此时平衡常数将___________(填“变大”、“变小”或“不变”),平衡将向__________(填“正”或“逆”)反应方向移动。
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是_______________________________________________。
(16分)Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)写出W的简单离子的原子结构示意图 ;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示) ;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
 ,
,
反应中每转移8mol 电子,消耗的还原剂质量为 g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)  CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2 = 2CO2+ 4H2O,则其正极的电极反应式
(10分)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:2CO(g)+O2(g)==2CO2(g) △H=-566KJ/mol
2H2(g)+O2(g)==2H2O(g) △H=-483.6KJ/mol H2O(g)== H2O(l) △H=-44.0KJ/mol
(1)1mol氢气燃烧生成液态水时放出的热为____________
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式_________________________。
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为___________;反应达到平衡后,升高温度,此时平衡常数将___________(填“变大”、“变小”或“不变”),平衡将向__________(填“正”或“逆”)反应方向移动。
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是_______________________________________________。
查看习题详情和答案>>