题目内容
(16分)Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)写出W的简单离子的原子结构示意图 ;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示) ;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
 ,
,
反应中每转移8mol 电子,消耗的还原剂质量为 g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)  CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2 = 2CO2+ 4H2O,则其正极的电极反应式
Ⅰ(1)硫离子的结构示意图(略);H-O-O-H
(2 )NH4+ +H2O
)NH4+ +H2O NH3·H2O + H+[来源:学,科,网]
NH3·H2O + H+[来源:学,科,网]
(3)C + 4HNO3 CO2↑ +4NO2↑ +2H2O,24g
CO2↑ +4NO2↑ +2H2O,24g
(4)O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案也可以)
Ⅱ 83.3%
Ⅲ O2 + 4H+ +4e- =2H2O
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案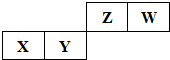 短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )| A、气态氢化物的稳定性:Y>Z | B、一定条件下,Z单质与W的常见单质直接反应生成ZW2 | C、原子半径:X>Y>Z>W | D、Y、Z的最高价氧化物均为共价化合物 |
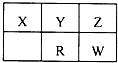 短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )
短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )| A、原子半径从小到大:X<Y<R<W | B、Z、W元素与X均可以形成AB2型化合物 | C、X有多种同素异形体,而Z不存在同素异形体 | D、Z的氢化物稳定性大于W的氢化物稳定性,是因为Z的氢化物分子间存在氢键 |
 短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )
短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )| A、X 和Y都是非金属元素,其中X最高化合价为+5价 | B、X、W的最高价氧化物在一定条件下能反应 | C、元素X、W和氧元素可形成化学式为W2XO3共价化合物 | D、Y、Z的氢化物的稳定性:Y<Z |


