摘要:含Cl2 . H2O. HClO .H+ .Cl-.ClO-, 氯水溶液含有HCl等物质而呈酸性, 光照 氯水中的HClO具有漂白性, 氧气, 2HClO = 2HCl+O2↑
网址:http://m.1010jiajiao.com/timu3_id_161327[举报]
(1)按要求写出下列反应的离子方程式
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是 ;能参与Zn反应生成氢气的是 ;能与硝酸和硝酸银的混合液作用生成白色沉淀的是 ;能使染料和有机色质褪色的是 .用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是 ;b是 .
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,在相同温度和相同压强条件下,体积最大的是 ,密度最小的是 .
②在 mL 0.2mol?L-1 NaOH溶液中含1g溶质;配制50mL 0.2mol?L-1 CuSO4溶液,需要CuSO4?5H2O g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是 ,还原剂是 ,耗1mol氧化剂,则被氧化的还原剂的物质的量是 mol.
查看习题详情和答案>>
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是
②在
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是
(1)按要求写出下列反应的离子方程式
硫酸溶液中滴加氢氧化钡溶液______
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是______;能参与Zn反应生成氢气的是______;能与硝酸和硝酸银的混合液作用生成白色沉淀的是______;能使染料和有机色质褪色的是______.用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是______;b是______.
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,密度最小的是______.
②在______mL0.2mol?L-1NaOH溶液中含1g溶质;配制50mL0.2mol?L-1CuSO4溶液,需要CuSO4?5H2O______g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是______,还原剂是______,耗1mol氧化剂,则被氧化的还原剂的物质的量是______mol.
查看习题详情和答案>>
硫酸溶液中滴加氢氧化钡溶液______
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是______;能参与Zn反应生成氢气的是______;能与硝酸和硝酸银的混合液作用生成白色沉淀的是______;能使染料和有机色质褪色的是______.用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是______;b是______.
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,密度最小的是______.
②在______mL0.2mol?L-1NaOH溶液中含1g溶质;配制50mL0.2mol?L-1CuSO4溶液,需要CuSO4?5H2O______g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是______,还原剂是______,耗1mol氧化剂,则被氧化的还原剂的物质的量是______mol.
(2011?丰台区一模)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水.某同学想在实验室探究Cl2性质并模拟制备漂水,如图是部分实验装置.已知KMnO4与盐酸溶液反应可以制取Cl2.
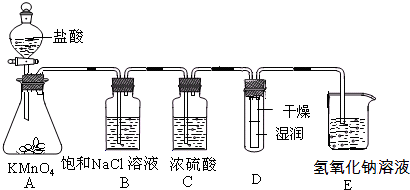
(1)配制物质的量浓度为0.375mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和
(2)浓硫酸的作用是
(3)装置E中发生化学反应的离子方程式为
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明)
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的.请判断该解释是否合理
(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为
查看习题详情和答案>>

(1)配制物质的量浓度为0.375mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和
容量瓶
容量瓶
.(2)浓硫酸的作用是
干燥氯气
干燥氯气
.(3)装置E中发生化学反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明)
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
.(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的.请判断该解释是否合理
不合理
不合理
,并分析产生上述实验现象的原因实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
;如需改进,请简述设计方案取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
(若认为合理.则此问可不作答).(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为
0.5
0.5
mol.(2010?信阳二模)I.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
Ⅱ.现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题:
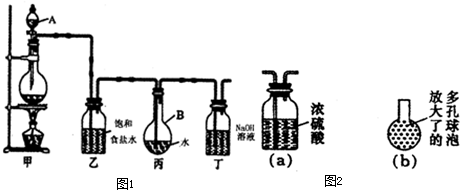
(1)写出有关化学方程式.
装置甲:
装置丁:
(2)证明氯水已饱和的现象是
(3)制取结束时,装置丙的液体中含有的微粒是
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?
②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:
③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:
查看习题详情和答案>>
ABD
ABD
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
Ⅱ.现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题:

(1)写出有关化学方程式.
装置甲:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
装置丁:
2NaOH+Cl2=NaCl+NaClO+H2O
2NaOH+Cl2=NaCl+NaClO+H2O
.(2)证明氯水已饱和的现象是
丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体
丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体
(3)制取结束时,装置丙的液体中含有的微粒是
Cl2、H2O、HClO、H+、Cl-、OH-、ClO-
Cl2、H2O、HClO、H+、Cl-、OH-、ClO-
(用微粒符号表示)(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?
无
无
.②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:
增加氯气与水的接触面积,吸收更充分
增加氯气与水的接触面积,吸收更充分
③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:
使测定的pH减小
使测定的pH减小
.(2000?上海)我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式
(2)凝聚剂除去悬浮固体颗粒的过程
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4?7H2O常用的凝聚剂,它在水中最终生成
(3)通入二氧化碳的目的是
(4)气体A通常使用氯气,氯气的作用是基于其和水反应的产物之一具有
(5)下列物质中能作为氯气的代用品的是
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
查看习题详情和答案>>
| pH值 | 6.5-8.5 |
| Ca2+,Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式
HCO3-+OH-=CO32-+H2O;
HCO3-+OH-=CO32-+H2O;
(2)凝聚剂除去悬浮固体颗粒的过程
③
③
(填写编号,多选倒扣)①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4?7H2O常用的凝聚剂,它在水中最终生成
胶状Fe(OH)3
胶状Fe(OH)3
沉淀.(3)通入二氧化碳的目的是
除去Ca2+
除去Ca2+
和调节PH值
调节PH值
.(4)气体A通常使用氯气,氯气的作用是基于其和水反应的产物之一具有
强氧化
强氧化
性,请写出氯气与水反应的离子反应方程式Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
.(5)下列物质中能作为氯气的代用品的是
①③
①③
(填写编号,多选倒扣)①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.