摘要: (1)CaF2或BeCl2,CS2 (2)MgS (3)NaOH (4)H2b-mXOb
网址:http://m.1010jiajiao.com/timu3_id_161172[举报]
(2009?南平二模)【化学--选修物质结构与性质】
氮元素可形成卤化物、叠氮化物及络合物等.
(1)NF3构型为三角锥体,沸点-129℃;可在铜催化作用下由F2和过量NH3反应得到.
NF3属于
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子、离子有:
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、Fe(CN)64-.写出钴原子在基态时的价电子排布式:
Co[(N3)(NH3)5]SO4中钴的配位数为
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小.
查看习题详情和答案>>
氮元素可形成卤化物、叠氮化物及络合物等.
(1)NF3构型为三角锥体,沸点-129℃;可在铜催化作用下由F2和过量NH3反应得到.
NF3属于
分子
分子
晶体,写出制备 NF3的化学反应方程式:4NH3+3F2
NF3+3NH4F
| ||
4NH3+3F2
NF3+3NH4F
.
| ||
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子、离子有:
N2O或CO2或CS2或BeCl2
N2O或CO2或CS2或BeCl2
、SCN-或OCN-或CNO-
SCN-或OCN-或CNO-
(各举1例),由此可推知N3-的空间构型是直线
直线
型.②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、Fe(CN)64-.写出钴原子在基态时的价电子排布式:
3d74s2
3d74s2
.Co[(N3)(NH3)5]SO4中钴的配位数为
6
6
,CN-中C原子的杂化类型是sp
sp
.(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是
极性
极性
(填“极性”、“非极性”)分子.(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
BC
BC
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小.
 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:(1)臭氧与氧气的关系是
同素异形体
同素异形体
.(2)选出下列分子与O3分子的结构最相似的是
C
C
.A.H2O B.CO2 C.SO2D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有
5
5
对孤对电子.(4)O3分子是否为极性分子
否
否
(填是或否).(5)O3与O2间的转化是否为氧化还原反应
否
否
(填是或否).在周期表中,同一主族元素化学性质相似.目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则.据此请回答:
(1)锂在空气中燃烧主要产物的电子式是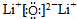
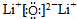 ,同时生成微量的
,同时生成微量的
(2)铍的最高价氧化物对应的水化物的化学式是
(3)若已知反应Be2C+4H2O═2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
 .
.
查看习题详情和答案>>
(1)锂在空气中燃烧主要产物的电子式是
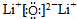
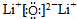
Li3N
Li3N
;(2)铍的最高价氧化物对应的水化物的化学式是
Be(OH)2
Be(OH)2
,它属两性化合物,证明这一结论的有关离子方程Be(OH)2+2H+═Be2++2H2O
Be(OH)2+2H+═Be2++2H2O
,Be(OH)2+2OH-═BeO22-+2H2O
Be(OH)2+2OH-═BeO22-+2H2O
;(3)若已知反应Be2C+4H2O═2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
Al4C3+4OH-+4H2O═4AlO2-+3CH4↑
Al4C3+4OH-+4H2O═4AlO2-+3CH4↑
;(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
将BeCl2加热至熔融状态,不能导电,证明BeCl2是共价化合物
将BeCl2加热至熔融状态,不能导电,证明BeCl2是共价化合物
,用电子式表示BeCl2的形成过程:

一般地,晶体类型不同,其结构和性质也不同.
(1)下表是四种同主族元素的氧化物的离子晶体晶格能数据.
①将上表中四种氧化物的共熔物冷却,首先析出的是
②碳酸盐的热分解示意图如图1.两种碳酸盐的热分解温度CaCO3

(2)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,当氨水冷却时,可以将NH3?H2O和2NH3?H2O等晶体沉淀出来.
①2NH3?H2O的晶体类型为
②NH3极易溶于水,其主要原因是
(3)CaF2的晶体结构如图2所示.
①CaF2晶体中钙离子的配位数是
②一个CaF2晶胞中包含
查看习题详情和答案>>
(1)下表是四种同主族元素的氧化物的离子晶体晶格能数据.
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
BaO
BaO
.②碳酸盐的热分解示意图如图1.两种碳酸盐的热分解温度CaCO3
高于
高于
SrCO3(填“高于”或“低于”)
(2)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,当氨水冷却时,可以将NH3?H2O和2NH3?H2O等晶体沉淀出来.
①2NH3?H2O的晶体类型为
分子晶体
分子晶体
.②NH3极易溶于水,其主要原因是
NH3与H2O形成分子间氢键
NH3与H2O形成分子间氢键
.(3)CaF2的晶体结构如图2所示.
①CaF2晶体中钙离子的配位数是
8
8
.②一个CaF2晶胞中包含
4
4
个钙离子.下表是某些短周期元素的电负性(x)值:
(1)根据表中数据归纳元素的电负性与原子吸引电子的能力的关系
(2)试推测,周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为
 .
.
(3)已知:Cl-Br+H-OH H-Cl+HO-Br.
H-Cl+HO-Br.
①若NCl3最初水解产物是NH3和HOCl,则x(Cl)的最小范围:
②PCl3水解的化学反应方程式是
(4)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(3)-①,分析BeCl2属于
请设计实验加以证明
查看习题详情和答案>>
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| X值 | 0.98 | 1.57 | 3.04 | 3.44 | 3.98 | 0.93 | 1.31 | 1.61 | 2.19 | 2.58 |
元素的电负性越大,原子吸引电子的能力越强
元素的电负性越大,原子吸引电子的能力越强
.(2)试推测,周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为


(3)已知:Cl-Br+H-OH
 H-Cl+HO-Br.
H-Cl+HO-Br.①若NCl3最初水解产物是NH3和HOCl,则x(Cl)的最小范围:
2.58~3.04
2.58~3.04
(填表中数值);②PCl3水解的化学反应方程式是
PCl3+3H2O=3HCl+H3PO3(或P(OH)3)
PCl3+3H2O=3HCl+H3PO3(或P(OH)3)
.(4)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(3)-①,分析BeCl2属于
共价化合物
共价化合物
.(填离子化合物或共价化合物)请设计实验加以证明
测定熔融态的BeCl2不导电
测定熔融态的BeCl2不导电
.